2015年7月22日,国家食药监总局发布公告,对申请上市的1622个药品注册申请,要求企业自查,数据不真实的要主动撤回。
一石激起千层浪,之后的两年内,在已申报生产或进口待审的药品的临床核查,申请人主动撤回1316个,占比64.7%,申请减免临床等不需要核查的注册申请258个,占12.7%。
截止2017年6月,已核查的313个药品注册申请,有38个涉嫌临床试验数据造假;并对11个涉嫌造假的试验机构或CRO立案调查。
时至今日,该事件已经过去8年,使我国医药研发重新出发,在审评审批及医保提速、政策鼓励的大好形势下,我国医药研发蓬勃发展。
“以史为鉴,可以知兴替。”历史可能会重演,所以才更值得我们借鉴,特别是入行比较晚的,更需要了解历史。
此前,笔者写过一篇《阵痛过后见曙光——“7•22”两周年》,原文发布于2017年7月21日,以下为正文:
自2015年7月22日起,国家食品药品监管总局(以下简称CFDA)进入新政模式/加急模式,医药新政层出不穷,第一个政策还没有来得及读懂,甚至还没有读完,第二个政策又出来了,而且常常在周末等节假日前出台,让企业相关人员只有在大好时光中埋头研究政策了。算起来医药新政距今刚好两年时间,笔者不才,愿为读者梳理之。
2015年5月,CFDA大幅度提高药品注册收费标准,试图用经济杠杆压缩药品申报数量,吹响了本轮医药新政改革的号角,于是接着在2015年7月下发了《开展药物临床试验数据自查核查的公告》,引发了药界“7•22”事件(大部分的临床试验未能通过核查),也正式宣告了医药新政的开始。
医药新政开始后,给行业带来了巨大阵痛,当一些没有研发实力的中小企业还在暗自庆幸,自己没有做临床试验,“7•22”与己无关时,第二波新政重磅出击,2016年2月《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》发布。原本涉及289个品种,批准文号情况总共有17740个,但从市场的角度出发,企业更是积极投身于289个品种,于是引发了口服固体制剂仿制药一致性评价的全面铺开。
当然新政也有令人愉快的地方,那就是CFDA实施了加快解决药品注册申请积压问题的相关政策和措施,让一些高年资研究员感动得老泪纵横:“啊,终于有望在退休前看到自己研发的药品上市了”。
与此同时,为了解决药品注册申请积压的矛盾,充分利用审评资源,加快具有临床价值的新药和临床急需仿制药的研发上市,CFDA于2016年2月颁布了优先审评审批制度,大大地加强了药品申报领域的“马太效应”:越是市场需要、市场大的好品种越能快速的上市,获得经济效益。
两个政策的叠加,使得好产品的审批速度,好似由老牛拉车变成了坐飞机,不信?直接上图上数据。
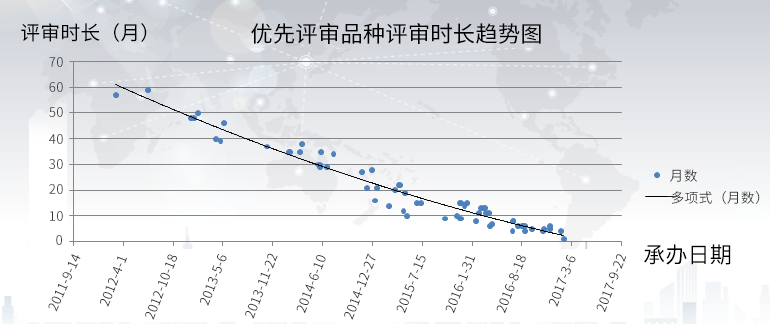
从上图可见,2012年申报的一个品种(还赶上了优先审评的末班车)花了近60个月完成审评审批,而到了2016新申报的品种基本在10个月内完成审评。
除此之外,还有化药注册分类改革,BE备案制、国外临床试验数据被认可,国际新药临床试验可以同步开展等政策已得以实施,专利链接制和数据保护制度提上日程、新药品注册管理办法正在征求意见……
简而言之,CFDA的药品研发新政的思路主要就是与国际化接轨,鼓励创新、减少低水平重复研究。有人开玩笑说CFDA都要变成FDA了,我说,这非常好呀,医药产业是受政策影响最大的,正是科学的FDA造就了强大的美国医药产业。最近中国还加入了ICH(医药界的WTO),中国药企业只有在一个良好科学的政策环境中,才能壮大、走向全球。
新政的实施,将改善国内某些特殊药品的患者用药问题:
一方面,国际创新药要晚5-8年才能在中国上市,患者面临有药不能用的处境;另一方面,原研药即使专利到期很久了,由于国内仿制药临床试验数据不靠谱,质量不过关,不能替代原研药,医药费用居高不下。
而在新政下,国际新药可同步上市;一旦专利到期之后,又有良好的仿制药迅速替代原研药市场。既保障了药物可及性,又控制了费用,既鼓励了创新,也给仿制药一个空间。

除此之外,医药新政还有一个使命,那就是提高产业集中度,提高门槛,让过多的企业、过多的批文消失于新政中,而两票制则是想让流通行业过多的小医药公司消失。
看似残酷,其实也是必然之路。
所以,阵痛过后见曙光,指的是医药产业整体,指的是具有创新意识,有研发能力、进入创新轨道的企业,而那些抱残守缺、守着老品种过日子的企业看到的仍将只是一抹晚霞。
由于持续的新政实施,也打消了药界“7?22”发生时大家关于“运动式的检查之后又死灰复燃”的担忧。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57