近日,恒瑞医药宣布,NMPA 已核准签发PD-L1单抗阿得贝利单抗、HER3 ADC注射用SHR-A2009的《药物临床试验批准通知书》,恒瑞将于近期开展临床试验。具体为:阿得贝利单抗联合阿美替尼或SHR-A2009加或不加化疗用于晚期实体瘤患者。

SHR-A2009是恒瑞医药自主研发的以HER3为靶点的抗体药物偶联物。SHR-A2009由全人源HER3 IgG1单克隆抗体和SHR169106偶联而成,SHR169106是由可酶切的含马来酰亚胺四肽(GGFG)的连接子与9106-IM-2组成,9106-IM-2为DNA拓扑异构酶I抑制剂。SHR-A2009的平均药物抗体偶联比(DAR)为4。
虽然目前免疫检查点抑制剂联合ADC的组合疗法正在被各大药企青睐,但全球还没有HER3 ADC联合免疫检查点抑制剂的相关临床试验开展,恒瑞医药成了“第一个吃螃蟹的人”。SHR-A2009于2021年8月首次申请临床,同年10月公示启动临床,目前有2项临床试验登记,恒瑞公告显示,截至目前,相关项目累计已投入研发费用约4685万元,此产品被恒瑞医药寄予厚望。
HER-3与肿瘤治疗
人表皮生长 因子受体(HER)蛋白是一个受体酪氨酸激酶家族,由4个高度同源的成员组成:表皮生长 因子受体(EGFR,也称ERBB1/HER1)、HER2(ERBB2)、HER3(ERBB3)和HER4(ERBB4)。
HER3作为HER家族成员之一,不仅可以单独诱导肿瘤发生,而且可以和其他家族成员协同诱导肿瘤发生、转移进展、药物抵抗(包括放化疗、内分泌治疗耐药)。
HER3在多种实体肿瘤中均有表达,包括乳腺癌、肺癌等,其中在NSCLC肺癌中占80%左右,乳腺肿瘤中占30%~50%左右。HER3可激活PI3K/AKT、MAPK、JAK/STAT等信号通路,这些信号通路的激活与他莫昔芬、西妥昔单抗、曲妥珠单抗、吉非替尼、厄洛替尼、奥希替尼、多西他赛等耐药相关。因此HER3是重要治疗靶点。
针对HER3靶点的药物研发主要基于以下几个原理:
1)将HER3锁定在“束缚”状态;
2)捕获其高亲和力配体——神经调节蛋白(NRG);
3)阻断配体结合位点;
4)促进HER3的内化;
5)阻碍HER3与HER家族其他成员的异二聚化;
6)促进免疫细胞清除表达HER3的肿瘤细胞 。
HER3二聚体及其介导的信号转导级联
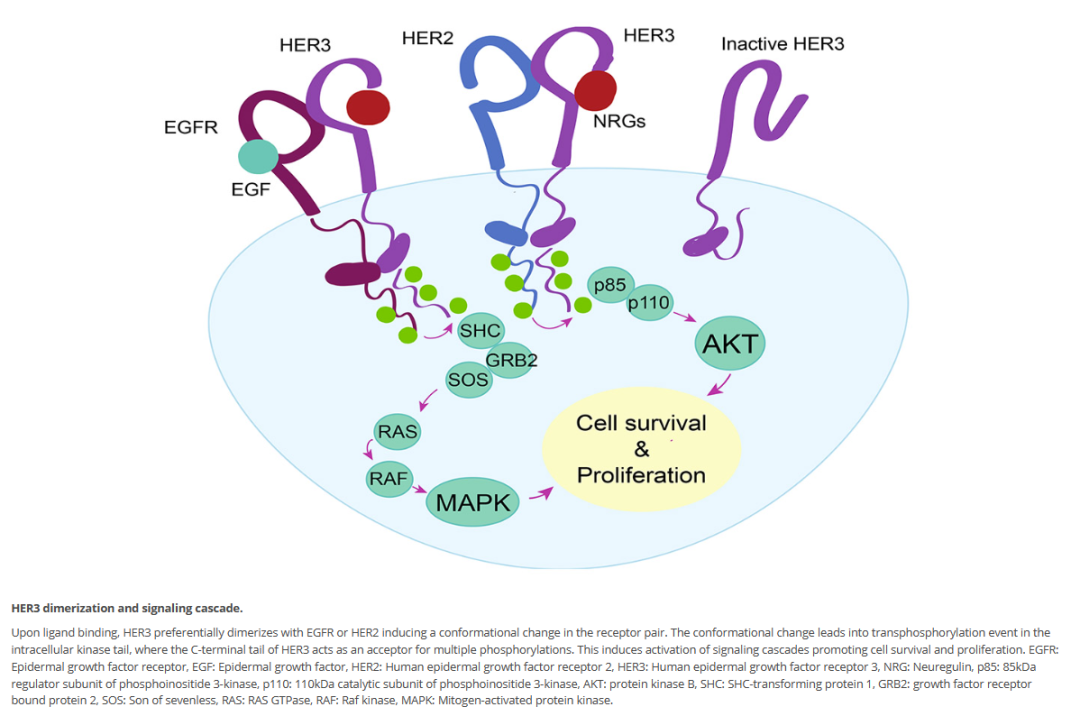
图片来源:参考来源5
HER-3 ADC药物研发进展
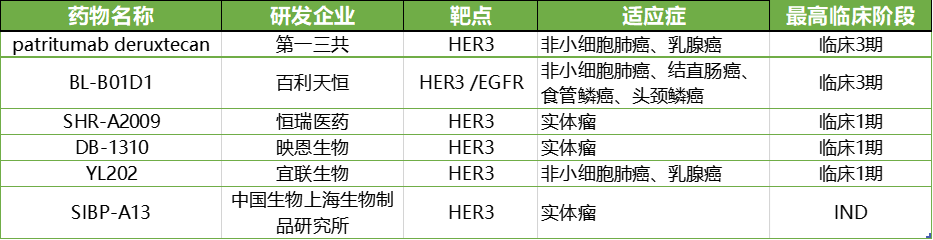
目前,全球范围内尚无HER3靶向ADC获批上市,进度领先的为第一三共开发的Patritumab deruxtecan,处于3期临床阶段。HER3 ADC由于Patritumab deruxtecan在EGFR突变NSCLC适应症上的惊艳表现而受到看好,据药渡数据库显示,当前全球仅17款HER3 ADC,进入临床的仅仅6款。国内参与者以百利天恒(BL-B01D1,EGFR/HER3双靶点)、恒瑞医药(SHR-A2009)、映恩生物(DB-1310)和宜联生物(YL202)为代表,其中百利天恒(BL-B01D1)进展最快,已经进入3期临床阶段;恒瑞医药(SHR-A2009)、映恩生物(DB-1310)、宜联生物(YL202)尚处于1期临床,适应症探索主要集中在非小细胞肺癌、乳腺癌、食管癌等实体瘤领域。
全球处于临床阶断HER3 ADC
Patritumab deruxtecan(U3-1402)
U3-1402是第一三共开发的靶向HER3的ADC药物。U3-1402的抗体部分为HER3单抗Patritumab(U3-1287),通过linker共价偶联拓扑异构酶I抑制剂依喜替康(Exatecan,MAAA-1181a),每个抗体连接有8个依喜替康。通过与癌细胞表面的HER3结合,U3-1402被内吞入细胞内释放出依喜替康,进而发挥细胞毒作用,杀灭癌细胞。目前U3-1402已被美国FDA授予突破性疗法资格,用于接受过第三代EGFR靶向药和铂类化疗后疾病进展的转移性或局部晚期EGFR阳性非小细胞肺癌患者。
在针对携带EGFR突变的转移性非小细胞肺癌(NSCLC)患者的1期临床试验中,Patritumab deruxtecan也显示了良好的临床疗效。试验采用盲态独立中心审评(BICR),102例患者的ORR为40.2%,1例患者达到完全缓解(CR),40例患者达到部分缓解(PR),39例患者达到疾病稳定(SD),疾病控制率(DCR)为78.4%,中位DOR为7.6个月,中位PFS为6.4个月,中位OS为15.8个月。值得注意的是,对于已接受过4线治疗的晚期或转移性如EGFR突变NSCLC患者,尤其是EGFR耐药患者,超过15个月的总生存期,已经算是史无 前例的数据。
另外,U3-1402在乳腺癌的相应临床试验也在扎实推进中,已经在治疗表达HER3的转移性乳腺癌早期临床试验中获得积极结果。去年7月,第一三共(Daiichi Sankyo)已启动一项名为HERTHENA–Lung02的国际多中心(含中国)3期临床试验,以评估U3-1402相比含铂化疗在携带EGFR激活突变的转移性或局部晚期非鳞状非小细胞肺癌(NSCLC)受试者中的有效性。其在国内的3期临床也在今年5月正式启动,针对非小细胞肺腺癌19/21外显子突变且三代靶向药耐药的患者。
U3-1402结构及作用机制
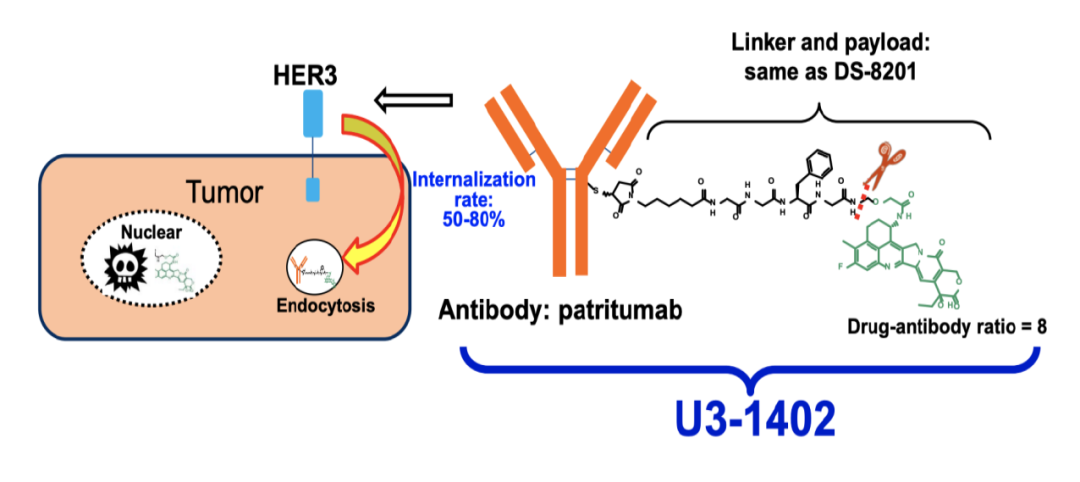
图片来源: 第一三共官网
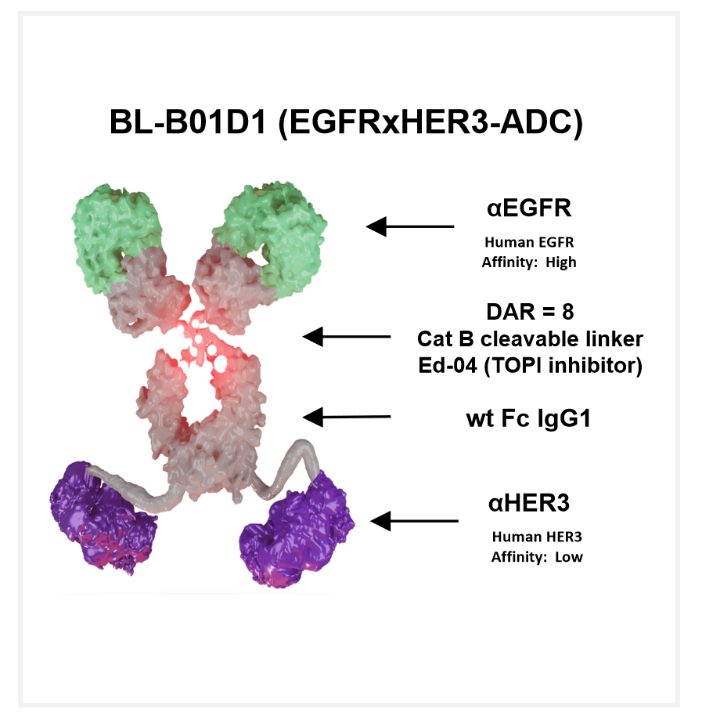
BL-B01D1
BL-B01D1是百利天恒公司自主研发的全球独家的靶向EGFR/HER3双靶点的重组人源化ADC药物,一方面可同时结合肿瘤细胞上的EGFR和HER3,实现对两个肿瘤相关靶点的同时阻断,以此获得靶向性和增强的抗肿瘤活性。目前在研ADC大多数是靶向单一靶点,BL-B01D1的突出优势在于可同时靶向EGFR、HER3,精准杀灭肿瘤细胞;并且这两个靶点在实体瘤中发生率较高,可覆盖更多人群。
药渡数据库显示,BL-B01D1已在非小细胞肺癌、结直肠癌、食管鳞癌、头颈鳞癌等多个上皮肿瘤上开展7个2期临床研究。BL-B01D1首项人体1期临床研究亮相今年ASCO会议,临床试验数据显示:使用BL-B01D1的RP2D推荐剂量2.5mg/kg D1、D8 Q3W治疗后,各肿瘤的总有效率(ORR)为45.3%,中位随访时间为4.1个月,PFS尚未达到。在38例EGFR阳性NSCLC患者中,其中有34例患者曾接受过三代EGFR-TKI治疗后耐药,整体ORR可达到63.2%;EGFR 野生型NSCLC患者组的ORR为44.9%;鼻咽癌组ORR为53.6%。
DB-1310
DB-1310是映恩生物基于其DITAC技术平台开发的靶向HER3的ADC产品,由新型人源化抗Her3单克隆抗体通过马来酰亚胺可裂解linker与专有的DNA拓扑异构酶I抑制剂共价连接,DAR值约为8。今年AACR大会上,根据映恩生物公布的最新临床前研究中显示,DB-1310表现出优于U3-1402的肿瘤抑制效果和安全性;并且在与EGFR小分子抑制剂联合治疗中表现出优秀的协调治疗效果。
今年5月24日,据CDE官网公示,映恩生物的HER3 ADC药物“注射用DB-1310”临床试验申请获得临床试验默示许可(受理号:CXSL2300200),拟用于治疗晚期/转移性实体瘤。
YL202
宜联生物的YL202是一款靶向Her3靶点的ADC药物。根据官网信息,YL202项目已于近期在美国顺利完成临床1期试验的首例患者给药。该试验为一项国际多中心临床研究,旨在评估YL202在晚期非小细胞肺癌和乳腺癌患者中的安全性、耐受性、药代动力学和抗肿瘤活性。其在国内的一期临床也正在开展中,用于晚期实体瘤治疗。
SIBP-A13
SIBP-A13是上海生物制品研究所基于第3代ADC技术研发的靶向HER3 ADC新药,具有连接子可裂解、载荷活性强、抗肿瘤“旁观者效应”等药物优势。SIBP-A13具有完全自主知识产权,其中抗HER3单抗分子、偶联技术连接子均为自主研发,临床前数据显示其可有效抑制多种肿瘤生长,具有良好耐受性,临床上拟用于晚期恶性实体瘤治疗。SIBP-A13在抗体基础上偶联小分子细胞毒 性药物,兼具了抗体的靶向性和细胞毒 性药物的杀伤性。其可借助抗体靶向作用与肿瘤细胞表面的靶抗原结合,而偶联小分子药物则经内吞效应进入肿瘤细胞并释放,从而精准杀伤肿瘤细胞以及肿瘤周围病变细胞。
目前SIBP-A13临床试验申请获国家药品监督管理局药品审评中心(CDE)正式受理。
参考来源
CDE官网
映恩生物官网
百利天恒官网
第一三共官网
Thirty Years of HER3: From Basic Biology to Therapeutic Interventions. Clin Cancer Res. 2021;27(13):3528-3539
https://www.businesswire.com/news/home/20230317005395/en/Patritumab-Deruxtecan-Continues-to-Show-Encouraging-Clinical-Activity-in-Distinct-Patient-Populations-with-Metastatic-Lung-and-Breast-Cancer-in-Updated-Results-of-Two-Early-Trials
Patritumab Deruxtecan Granted U.S. FDA Breakthrough Therapy Designation in Patients with Metastatic EGFR-Mutated Non-Small Cell Lung Cancer. Retrieved December 23, 2021, from https://www.daiichisankyo.com/files/news/pressrelease/pdf/202112/20211223_E1.pdf
Patritumab Deruxtecan Continues to Show Promising Clinical Activity in Patients Across Subtypes of Metastatic Breast or Lung Cancer. Retrieved June 3, 2022, from https://www.businesswire.com/news/home/20220602005951/en



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57