自中国2017年加入国际人用药品注册技术协调会(ICH)后,NMPA出台了一系列监管政策以促进中国的药监体系与国际标准一致。
在过去十年中,NMPA先后推行实施了3个加速审批路径,包括优先审评(2017年)、突破性疗法认定(2020年)、附条件批准(2020年)。
其中,突破性疗法自实施以来,目前共计有115个品种(合计167个受理号)获得突破性疗法的认定,具体品种详见文末附表1。
当前研发形势下,如何借势突破性疗法等审批路径,加速药品审批?
起源FDA,
平均缩短2.5年时间
全球范围来看,FDA率先引入突破性治疗认定(Breakthrough Therapy Designation,BTD)。
FDA的案例显示,BTD认定的药物较非BTD认定的药物,研发至上市时间平均短2.5年,在创新药物临床可及性方面体现了较为明显的优势。
BTD一度成为创新药革命性突破的标签。
为了对标FDA在突破性治疗药物认定方面的程序,中国近年来也纳入突破性治疗认定条例,体现“以患者为中心”的药品注册体系导向。
具体来看,《国务院关于改革药品医疗器械审评审批制度的意见》为政策的顶层设计,《突破性治疗药物审评工作程序(试行)》为具体的指导守则,《药品注册管理办法》则是作为法规写进法律文本里,申请系统的开辟则是“绿色通道”的实操性落地。
这些文字的反复修订和落地,为医药产业发展和公众用药安全提供了极具价值的支持。
表1 政策汇总表

如何获得突破性疗法认定?
相关决策树解读
政策文件规定,在I、期临床试验阶段,通常不晚于亚期临床试验开展前申请突破性治疗,且药审中心对纳入突破性治疗药物程序的药物优先配置资源进行沟通交流,加强指导并促进药物研发。
对于纳入突破性治疗药物程序的品种,申请人经评估符合相关条件的,也可以在申请药品上市许可时提出附条件批准申请和优先审评审批申请。
可以在不做完III期临床研究即可申请上市,加快的商业化进程有利于抢占先机,各大企业都想要获得突破性治疗的资质认定。
怎么样的条件,才可能获得认定?
近日,于烟台举行的2023医药创新与发展国际会议上,国家药监局药品审评中心副主任杨志敏发表《科学审评推动中国医药创新高质量发展》演讲时说道,关于NMPA抗肿瘤药物决策树,如下图:
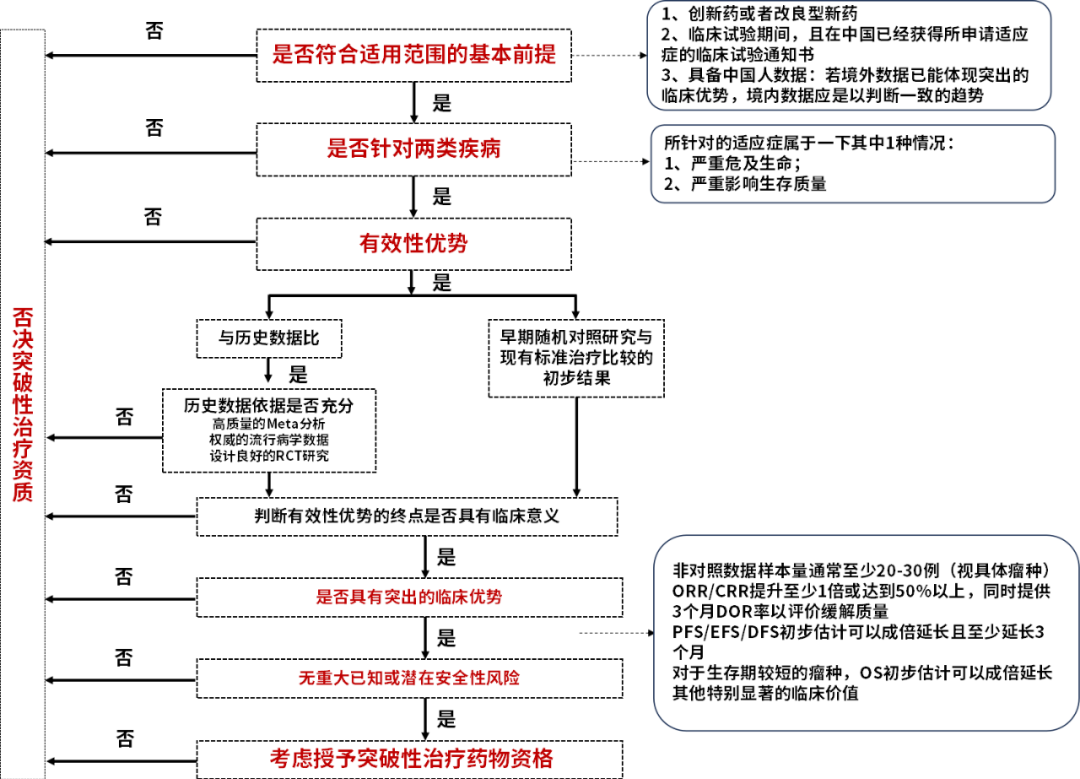
图1 突破性治疗资质认定决策树
资料来源:《科学审评推动中国医药创新高质量发展》,杨志敏副主任
从具体的决策逻辑而言,将经历4个决策节点:
第一,突破性治疗仅针对创新药或者改良型新药,而且获得所申请适应症对应的中国临床试验通知书,在已开展的临床数据中,必须具备中国人的人种数据,否则不具备突破性治疗资质。对于在国外开展临床的创新药,要想获得中国的突破性治疗,则必须走中国的临床申请和桥接程序。
第二,是否针对两类疾病,1、严重危及生命;2、严重影响生存质量,同时现存没有有效的治疗手段。换而言之,如果是已有治疗手段的疾病,例如常见感染、代谢疾病等,即使是创新药或改良型新药,也不具备授予资格。
第三,有效性优势是否具备临床意义,这里包括2层含义,一方面是临床试验数据必须是权威、高质量的,另外一方面是与历史数据或者早期随机对照研究数据对比具有明确有效的终点判断数据。反映出,如果临床数据质量不高,或者没有显著的优效数据,同样不具备授予资格。但是不一定要求有对照组。
第四,无重大已知或潜在安全性风险,药物的安全性要过关才可以,安全性和有效性缺一不可,但是安全性的要求对于有效性稍微低一点。
在这4点决策逻辑下,满足条件的可考虑授予突破性治疗药物资格,不具备其中一点的就会否决。
突破性疗法认定,
对企业开发新药的启示
建立“突破性治疗”审评通道是一个重大的监管里程碑。
突破性新药的授权对制药公司是缩短研发时间、简化试验设计、寻求CDE指导和提升公司知名度和融资的利器。
可以说,它是一个对未来明星药的选择和加速培养的“选秀”计划。
虽然这一个“选秀”不一定意味着百分百成才,但是至少是具备了“加速器”的潜能,也是探寻高确定性的一种可行路径。
那么,药企怎么踩准突破性治疗认定的政策红利呢?
第一,要明确什么是突破性治疗,是计划用于目前缺乏有效疗法的严重或危及生命的疾病,也就是说在这些疾病中,对疗效与安全性平衡考量与其他疾病有所不同。同质化的靶点和已有代表性药物的改良版,描述再天花乱坠也难以纳入;
第二,要明确临床优效数据的获取,授权的新药必须是在早期临床试验中显示了很高的疗效。可以使用I期或II期结果审报,而绕过漫长昂贵的三期临床试验或推迟到上市以后。这就意味着试验可以不设对照组,同时也可使用间接临床终点。
举一个例子,二代ALK靶向药在克唑替尼(一代ALK靶向药)耐药后仍有大约60%反应率,超高于二线化疗的15%的反应率,因此可推理出优效数据是具备说服力的。
第三,设置“突破性治疗药物”的目的是鼓励真正的创新,创新性的药物可以优先考虑采用生物标志物、替代终点改进临床终点评价指标、采用适应性临床试验优化设计方法等,大力鼓励企业走向“无人区”,而不需要有太多的顾虑。
突破性治疗一定程度上海预示着今后药物研发的新方向,谁能在新方向上拔得头筹,谁就能更从容应对“内卷”的竞争。
附表1 国内获得突破性治疗认定受理号盘点
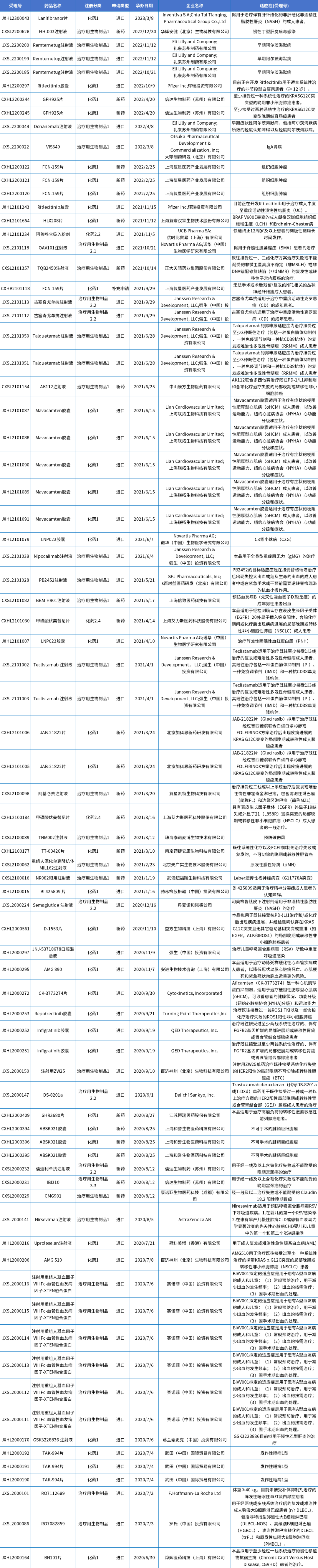
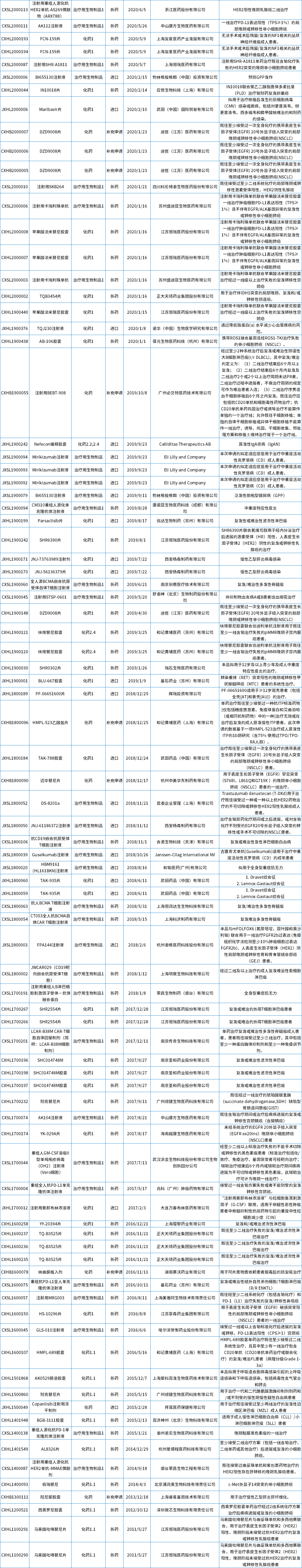
数据来源:药智数据



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57