8月5日,Sage Therapeutics和Biogen共同开发的Zurzuvae(zuranolone,SAGE-217)获美国FDA批准上市,成为首 个也是唯一一个批准用于治疗产后抑郁症(PPD)成人患者的口服疗法,预计将于2023年第四季度上市。
这意味着,除了静脉注射给药以外,又增加了一种治疗PPD患者的疗法。
实际上,产后抑郁只是抑郁症的主要分型之一,还包括单相和双相抑郁症、精神病性抑郁、更年期抑郁等不同种类。
受各方面因素影响,抗抑郁药研发的热度持续不减,国内外不少药企纷纷进军这一赛道。
首 款口服抗PPD疗法获批
翰森、腾盛布局新一代抗抑郁药
先来看产后抑郁症。
所谓产后抑郁,是指女性于产褥期出现明显的抑郁症状或典型的抑郁发作,与产后心绪不宁和产后精神病同属产褥期精神综合征,发病率在15%-30%,患病的原因包括激素作用、生活节奏紊乱、丧失生活主动权等。
据《2022年国民抑郁症蓝皮书》数据显示,中国每5个产妇中就有1个抑郁症,63%的女性曾患产后抑郁,20%的女性曾在怀孕期间患上抑郁症,孕产妇抑郁的发生率较高,但诊断率和治疗率较低。
尽管市面上有很多款抗抑郁药物,但由于都是通过影响单胺类神经递质(如5-羟色胺、去甲肾上腺素、多巴胺)的信号传递而发挥作用,存在起效慢、疗效欠佳等缺点。
2019年3月,FDA就曾批准上市了全球首 个靶向GABAA受体的抗抑郁新药Brexanolone,实现了PPD治疗药物零的突破。但这款药存在极大的劣势,就是需要连续静脉滴注60小时,显然对患者并不友好。
此次FDA批准上市的Zurzuvae,正是Brexanolone的升级产品,也是一款快速起效、每日一次、持续两周的口服抑郁新药,设计用于治疗重度抑郁症(MDD)和PPD。
Zurzuvae是一种神经活性类固醇γ-氨基丁酸A型(GABAA)受体阳性别构调节剂,靶向的是负责情绪、唤醒、行为和认知等功能的大脑网络,有助于快速重新平衡失调的神经元网络,以帮助恢复大脑功能,可以快速改善产后抑郁症女性的抑郁症状。
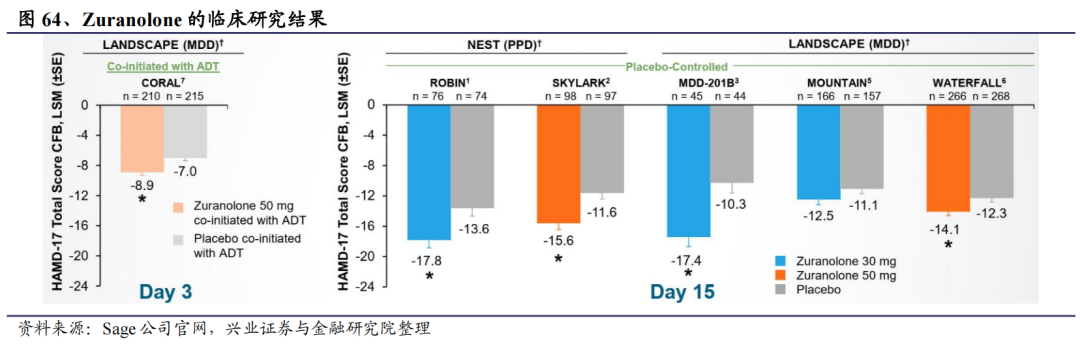
FDA的批准主要是基于两项随机双盲、安慰剂对照的多中心研究结果,其证实Zurzuvae治疗成人PPD的疗效。分析显示,与安慰剂组相比,Zurzuvae组患者的抑郁症状明显改善。在第42天(Zurzuvae末次给药后4周)仍维持治疗效果。
另外,根据2022年10月公布的SKYLARK临床3期试验结果显示,药物达成主要终点以及所有的关键次要终点。试验参与者在第3天开始便有快速与显著的抑郁症状改善,并一直持续至第45天。
目前,国内企业也有同类产品进入临床阶段,包括翰森制药的新一代GABAA受体正向变构调节剂HS-10353(口服)和腾盛博药的BRII-296(长效注射),均处于I期临床。
BRII-296
BRII-296是一种新型γ-氨基丁酸A(GABAa)受体阳性变构调节剂(PAM),也是一种首 创的新型、单次注射的治疗候选药,具有独特的长效剂型,无需停止哺乳,并使药物在患者结束注射后数周内有效。
作为单次注射治疗PPD的候选药物,与当前标准治疗相比,BRII-296可能具有更好的用药依从性、方便且副作用更少。
腾盛博药中枢神经系统疾病项目

来源:公司官网
此前,腾盛博药在2022年9月公布了BRII-296一期研究结果:单次肌内注射600mg的BRII-296实现线性剂量、早期药物吸收、逐渐和延长释放曲线,而无需剂量滴定或逐渐减少,为在该剂量下实现PPD治疗的临床疗效打下坚实基础。
2023年2月,腾盛博药向FDA提交BRII-296的1期研究IND申请,已开始给药。现阶段,腾盛博药正在积极扩大BRII-296的临床适应症,并计划于2024年在美国启动其他研究。
角逐高潜力赛道:绿叶制药率先突围
东阳光药、恒瑞抢滩布局
往大的层面看,抗抑郁药的研发不仅针对产后抑郁。庞大的患者人群,必然造就火热的市场竞争态势。
从患者人数看,全球有超过3.5亿抑郁症患者,其中中国就有超过9500万人。未来随着生活压力的不断加大,患者人数还将持续增加。
但这也意味着,抗抑郁药市场有着广阔的市场前景。根据Research and Markets报告分析,全球抗抑郁药市场规模预计从2022年的145亿美元增长至2030年的176亿美元,年复合增长率为2.5%;同期,预计中国抗抑郁药物市场规模从172亿元增长至238亿元,CAGR为4.2%。
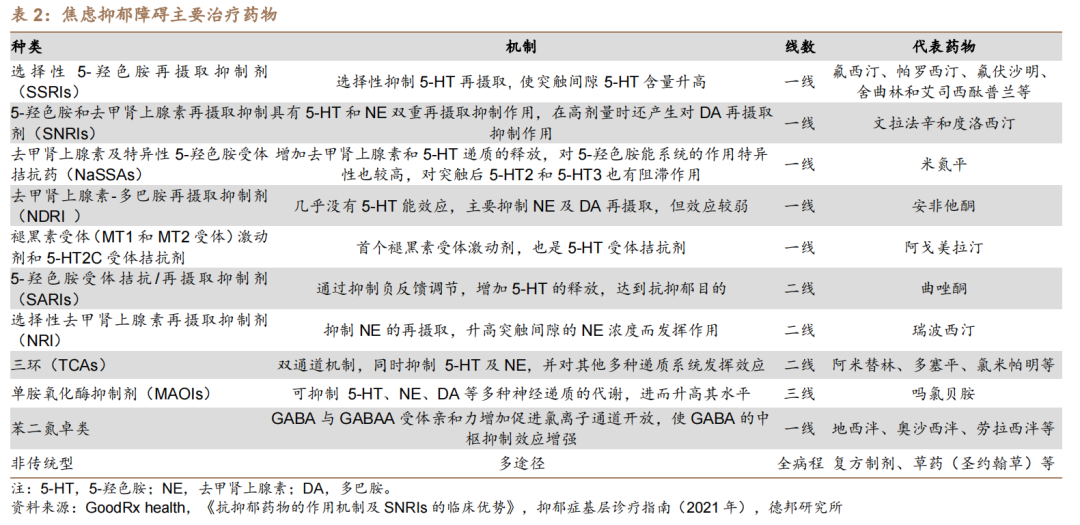
自1987年百优解(Prozac,氟西汀)获批上市以来,抗抑郁药的研发已有近40年的历史,目前主要机制基本围绕调节情绪因子,如5-羟色胺、去甲肾上腺素和多巴胺。
选择性5-HT再摄取抑制剂(SSRIs)是最为畅销的品种,2019年在全球抗抑郁药的占比为27.4%,而且SSRI和SNRI在国内的市场份额合计高达近90%。
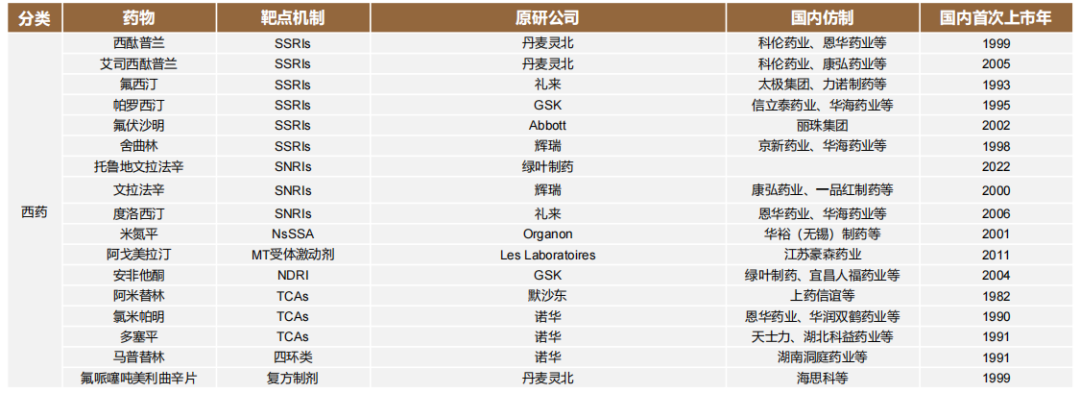
从市场情况看,由于原研药专利陆续到期、仿制药批量上市,目前国内抗抑郁药市场竞争尤为激烈,尤其是艾司西酞普兰、舍曲林和文拉法辛。
艾司西酞普兰方面,京卫制药、科伦药业等国产仿制药厂商的市场份额,已经超越原研厂家丹麦灵北制药;舍曲林的市场格局,也由辉瑞、京新药业和华海药业三家企业瓜分;文拉法辛市场由原研厂商辉瑞和抢占了首仿药的康弘药业瓜分,而且目前国内还有超过43个文拉法辛批文,竞争激烈程度不言而喻。
国内抗抑郁症主要上市西药
来源:德邦研究所
当然,除了仿制药以外,目前抗抑郁药的研发也在火热进行中,主要分为几种研发角度:或是剂型创新,如鼻腔喷雾剂,或是老药改良,比如复合制剂、基因改良等,或是研发NMDA、GABAA等新靶点。
盐酸艾司氯 胺 酮(Spravato)
强生研发的盐酸艾司氯 胺 酮(Spravato)就是一种鼻喷雾剂,通过与口服抗抑郁药联用,用于治疗对已有疗法产生抗性的成年严重抑郁症患者,此前已分别于2019年3月、2023年4月获FDA、NMPA批准上市。
盐酸托鲁地文拉法辛缓释片
绿叶制药历时12年研发并获批的国产首 个抗抑郁原创药——若欣林(盐酸托鲁地文拉法辛缓释片),便是基于文拉法辛进行改良的药物,在原有文拉法辛的结构上增加了一个可以脱卸的基团,使其不仅能够抑制5-HT和NE的再摄取,还能抑制DA的再摄取,成为市场中唯一的5-HT/NE/DA三重再摄取抑制剂。
Auvelity
新靶点研发方面,Axsome开发的Auvelity(右美沙芬+安非他酮)缓释片便是一种创新口服NMDA受体拮抗剂,而且是60多年来首 个获批的具有新机制的口服抗抑郁药,也是目前唯一一种能在一周内快速起效的口服抗抑郁药。
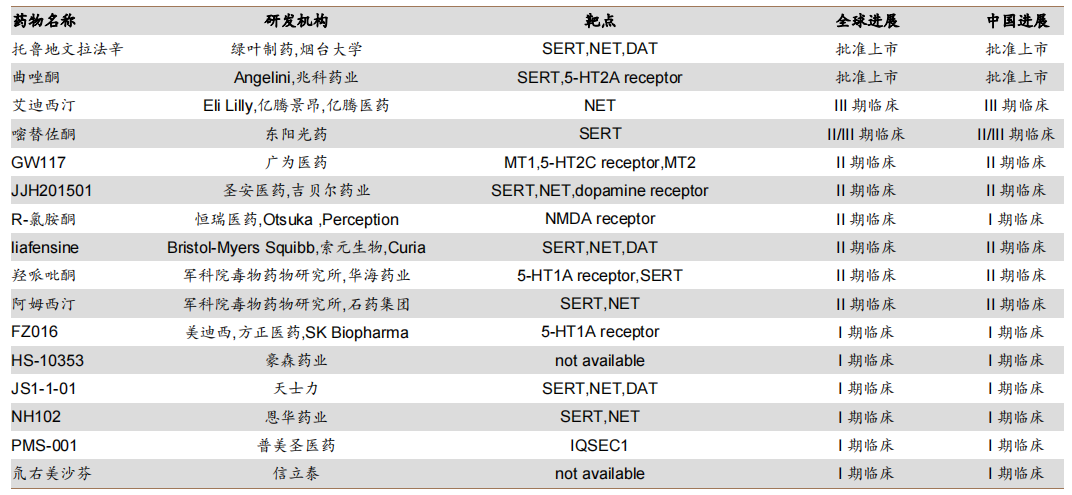
除此以外,国内还有十多家药企布局研发抗抑郁1类新药,包括东阳光药的嘧替佐酮、恒瑞医药的盐酸(R)-氯 胺 酮鼻喷剂、豪森药业的HS-10353等。
国内抗抑郁药物研发进展
来源:德邦研究所
结语
总体来看,当前国内抗抑郁药市场的竞争不局限于产后抑郁,也不仅仅是仿制药,新药研发同样呈现激烈态势。
当前,凭借前瞻性布局的绿叶制药已经带头突围,后来者东阳光药、恒瑞医药、腾盛博药等紧随其后。不难看出,一场激烈的竞速赛正在打响。
参考资料
1.《重磅!首 款口服抗产后抑郁疗法获FDA批准上市》,药明康德,2023-08-05》
2.《医药生物行业:美国Biopharma成长启示录》,兴业证券
3.《医药行业专题:焦虑抑郁症市场空间百亿量级,新药突破有望重塑市场格局》,德邦证券



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57