(文章传送门:当TKIs遇上慢粒白血病,CML的治疗、耐药与展望(上))。今日咱们书接上回,继续来谈谈“神药”TKIs药物。
除了BCR:ABL1依赖性耐药机制外,TKIs的耐药机制还与药物代谢、药物转运、表观遗传改变、蛋白磷酸酶、替代生存途径激活,以及还受白血病干细胞微环境的相互作用有关的机制影响。
04
“神药”的耐药
BCR:ABL1非依赖性耐药机制
1
药物转运蛋白
有证据表明,药物转运蛋白可通过降低细胞内的药物浓度或限制药物在某些组织中的生物利用度,从而导致耐药性。许多药物外排转运体和药物摄取转运体,与慢粒白血病的TKIs耐药性有关。
一些TKIs被认为是通过有机阳离子转运蛋白1(OCT1/SLC22A1)转运到肿瘤细胞中的。目前,OCT1在慢粒白血病中是否过表达尚有争议。有研究认为,OCT1的表达和活性,可作为慢性粒细胞白血病患者长期服用伊马替尼的监测指标[1]。
ATP结合盒(ABC)超家族由49个基因表达,其中一些成员与慢粒白血病有关。ABCB1是近年研究最广泛的药物转运蛋白之一。它是一种170kDa的细胞表面糖蛋白,可以通过泵出TKIs,在药物外排中发挥重要作用。
关于ABCB1多态性与慢粒白血病患者TKIs耐药性发展的相关性目前仍不清楚,没有令人信服的证据表明,ABCB1变体可作为药物治疗中的生物标志物。
有研究认为,ABCG2与白血病的发展有关[2]。ABCG2多态性同样会改变蛋白质对药物的转运能力。不过,仍需要更多的研究来确定,ABC转运蛋白多态性对慢粒白血病的影响。
2
药物代谢
TKIs是细胞色素P450酶(CYP3A4和CYP3A5)的底物,因此,可以合理地预测TKIs可受其他同细胞色素P450酶相关药物的影响[3]。这些药物包括利福平(rifampicin)、抗惊厥药(anticonvulsants)和天然药物(herbal remedies)等。如果TKIs药物代谢增加,TKIs的血浆浓度会降低,从而导致化疗耐药性[4]。
在存在药物遗传多态性的情况下,酶活性可能会受到影响,从而影响TKIs的代谢。具有临床意义的多态性,包括:CYP3A4*20和CYP3A4*22,这两种多态性都可能导致酶活性降低20%。目前,已知含有CYP3A4多态性的慢性粒细胞白血病患者可能会降低TKIs代谢,导致更大的副作用。
因此,在开始伊马替尼治疗时,应避免使用强效CYP3A4诱导剂。不过,关于CYP450变异在TKIs反应性中的意义,尚未完全确定。
3
表观遗传学改变
异常的DNA甲基化在慢性粒细胞白血病的进展中,也起着关键作用。与健康受试者相比,慢粒白血病患者的甲基化CpG位点显著增加,这表明CpG甲基化位点可能参与导致慢粒白血病的分子过程。这一结果也表明,慢粒白血病的病因可能不仅仅是BCR:ABL1易位,还可能与其他因素有关。
此外,miRNA可能也在慢粒白血病的发病机制和治疗耐药性中发挥作用。慢粒白血病患者血液样本中TKIs的存在,会影响miRNA的表达模式。此外,有反应和无反应的慢粒白血病患者的总体miRNA表达模式似乎各不相同[5]。不过,是否可以利用miRNA表达,来监测TKIs的治疗反应,仍存在争议。
4
白血病干细胞(LSCs)
白血病干细胞(LSCs)是一种能够自我更新,并具有耐药性的低频白血病细胞亚群。尽管它们似乎表达BCR:ABL1,但它们可以逃避TKIs效应,并增加复发的机会。在BCR:ABL1活性被抑制后,它们仍可以成为BCR:ABL1非依赖性TKIs抵抗机制[6]。
为了克服这一问题,目前的研究正在评估靶向LSCs的联合用药策略。例如,通过抗TNFα抗体英夫利昔单抗(IFX)与TKIs的联用,以诱导LSC对TKIs的易感性;或者CXCR4拮抗剂BKT140与TKIs联用,以克服骨髓环境的保护作用。此外,也可以靶向LSCs的信号通路,如LDE225靶向Hedgehog、吡格列酮靶向JAK/STAT等。
5
蛋白质酪氨酸磷酸酶
多种蛋白磷酸酶被认为参与了慢性粒细胞白血病的发病机制[7]。以γ型蛋白酪氨酸磷酸酶受体(PTPRG)为例,已有研究证实在TKIs应答者中,PTPRG的表达水平比无应答者高得多,且PTPRG的蛋白质水平是药物依赖性的,这表明旨在增强PTPRG活性的方法,可能有益于慢粒白血病患者治疗。
磷酸酶不仅在细胞增殖中起调节作用,还参与了LSC的静止和自我更新的调节(图1)。越来越多的证据表明,激酶和磷酸酶共同参与了CML的耐药性过程。
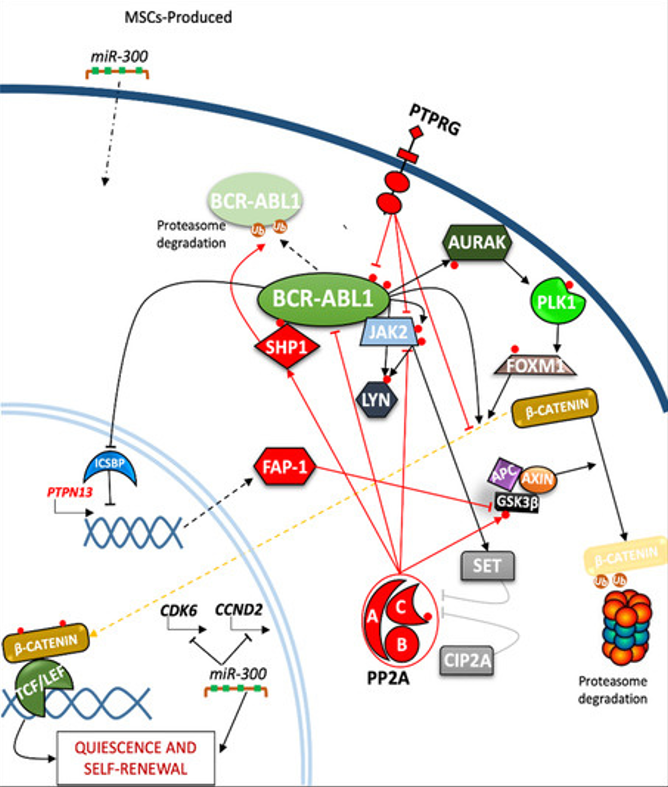
图1. 磷酸酶在慢粒白血病细胞自我更新和静止过程中的主要调节机制[7]
6
替代途径
BCR:ABL1融合蛋白的激活可触发PI3K-Akt、JAK-STAT和MAP激酶信号通路等,导致细胞增殖信号增强、抗凋亡信号传导、细胞运动性改变和基质细胞粘附性改变。这些途径中的许多信号蛋白,可激活BCR:ABL1依赖性致癌基因。当不同的刺激激活癌症细胞中的这些通路时,可能导致治疗失败或低反应率。许多信号系统不仅发生突变,还可能发生基因转录的变化。
因此,发现并结合关键的信号通路,设计一个最 佳的靶点来克服耐药性并引起合成致死性,是克服慢粒白血病耐药性的重要研究方向。
05
慢粒白血病治疗的未来展望
1
TKIs剂量个体化
用药个体化是精准治疗的重要部分,通过调整患者治疗方案,促进实现医源性损害最小化,医疗耗费最低化以及病患获益最大化,优化疗效并降低毒 性。目前剂量个体化可以借助治疗药物监测、群体药代动力学和药物基因组学等方法。
剂量个体化最常见的工具是治疗药物监测(TDM)。TDM参与稳定测量体液中药物水平,以更好地治疗患者。TDM已被证明可用于预测伊马替尼治疗慢性粒细胞白血病的疗效[8]。多项研究表明,伊马替尼(谷浓度)1000 ng/mL是需要达到的目标。这一浓度水平被认为是获得完全细胞遗传学反应和达到MMR的保证。
此外,药物遗传学(PGx)对癌症患者的剂量个性化也很重要。目前有超过10种化疗药物有临床PGx指南,但TKIs不是其中之一。不同的药物遗传变异会影响TKIs的疗效和毒 性,但由于数据矛盾,临床PGx指南目前仍然无法用于TKIs。
除了TDM和PGx,药效学或群体药代动力学模型(PPK)等其他剂量个体化技术也在发展。可能影响伊马替尼个体间差异性的变量,包括慢性伊马替尼暴露、遗传多态性、年龄和体重。群体药代动力学模型可以确定影响患者药物反应变异性的不同变量。可以将多个影响因素组合成一个数学模型,帮助预测患者的最 佳剂量。
2
TKIs的停药问题
TKIs治疗后的慢粒白血病患者的相对生存率,与普通人群大致持平。尽管TKIs治疗通常安全有效,但长期使用这些药物仍可能存在一定的风险。患者经常会遇到低级别、持续的不良事件。这些不良事件很常见,但可能会对他们的整体健康产生影响。此外,也有一些严重的不良事件被报告,例如动脉血栓形成事件和第二次恶性肿瘤的潜在风险增加[9]。
除了副作用及不良反应外,长期TKIs治疗给患者和社会带来的经济负担,是另一个重要因素。有研究尝试确定在已经建立长期深层分子反应或病情不太严重但稳定的患者中,TKIs是否可以安全地停药。目前,只有患者接受了至少5年的治疗、有2年的深层分子反应、没有既往耐药性或次优/警告反应史、且年满18岁的患者才可考虑停药[10]。
3
基因编辑
在过去的几年里,基因编辑技术在白血病治疗领域,获得了极大关注。CRISPR/Cas9系统可成功沉默BCR:ABL1癌基因,逆转其促肿瘤功能[11]。这表明CRISPR/Cas9技术,可以作为TKIs耐药的慢粒白血病患者的一种有前途的治疗新选择(图2)。然而,目前专门针对慢粒白血病的基因编辑研究尚不充分。
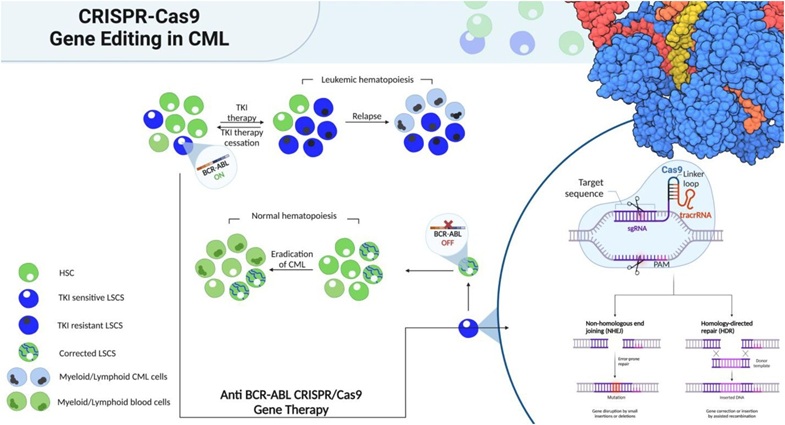
图2. 慢性粒细胞白血病的基因治疗与常规治疗[12]
结语
在与慢粒白血病的这场漫长决斗中,在“药神”的光辉之名传遍的背后,是无数的生物学家、药学家和一线医务工作者前赴后继的不懈努力。通过他们的努力,人类对疾病不再束手无策。“神药”伊马替尼的横空出世既是一座里程碑,同时也为我们带来了新的问题。
在TKIs的长期应用过程中,有患者产生了TKIs耐药性,也有患者出现了突发性危象。同时,治疗个体化也为TKIs的临床用药提出了更高的要求,基因编辑技术则为慢粒白血病的治疗提供了全新思路。
《我不是药神》的故事已经结束了,而人类与慢粒白血病不懈抗争的故事仍将继续书写下去。
参考文献:
1. Watkins DB, Hughes TP, White DL. BCR-ABL1 mutation development during first-line treatment with dasatinib or imatinib for chronic myeloid leukemia in chronic phase. Leukemia. 2015, 29: 1832-1838.
2. Scharenberg CW, Harkey MA, Torok-Storb B. The ABCG2 transporter is an efficient hoechst 33342 efflux pump and Is preferentially expressed by immature human hematopoietic progenitors. Blood. 2002, 99: 507-512.
3. Haouala A, Widmer N, Duchosal MA, et al. Drug interactions with the tyrosine kinase inhibitors imatinib, dasatinib, and nilotinib. Blood. 2011, 117: e75-e87.
4. Tian X, Zhang H, Heimbach T, et al. Effect of vemurafenib on the pharmacokinetics of a single dose of digoxin in patients with BRAFV600mutation-positive metastatic malignancy. J Clin Pharmacol. 2018, 58: 1067-1073.
5. San José-Enériz E, Román-Gómez J, Jiménez-Velasco A, et al. Microrna expression profiling in imatinib-resistant chronic myeloid leukemia patients without clinically significant ABL1-mutations. Mol Cancer. 2009, 8: 69.
6. Morotti A, Panuzzo C, Fava C, et al. Kinase-inhibitor-insensitive cancer stem cells in chronic myeloid leukemia. Expert Opin Biol Ther. 2014, 14(3): 287-299.
7. Boni C, Sorio C. Current views on the interplay between tyrosine kinases and phosphatases in Chronic Myeloid Leukemia. Cancers. 2021, 13(10): 2311.
8. García-Ferrer M, Wojnicz A, Mejía G, et al. Utility of therapeutic drug monitoring of imatinib, nilotinib, and dasatinib in chronic myeloid leukemia: a systematic review and meta-analysis. Clin Ther. 2019, 41: 2558-2570.
9. Douxfils J, Haguet H, Mullier F, et al. Association between BCR-ABL tyrosine kinase inhibitors for chronic myeloid leukemia and cardiovascular events, major molecular response, and overall survival. JAMA Oncol. 2016, 2(5): 625-632.
10. Rea D, Ame S, Berger M, et al. Discontinuation of tyrosine kinase inhibitors in chronic myeloid leukemia: recommendations for clinical practice from the French chronic myeloid leukemia study group. Cancer. 2018, 124(14): 2956-2963.
11. García-Tu?ón I, Hernández-Sánchez M, Ordo?ez JL, et al. The CRISPR/Cas9 system efficiently reverts the tumorigenic ability of BCR/ABL in vitroand in a xenograft model of chronic myeloid leukemia. Oncotarget. 2017, 8(16): 26027-26040.
12. Salma Y, Mohamed AI, Rana AJ, et al. Management of chronic myeloid leukaemia: current treatment options, challenges, and future strategies, Hematology, 2023, 28(1): 2196866.
作者简介
理性的蛋炒饭
药学背景,硕士毕业于中国药科大学,熟悉药物项目调研及药物研究工作。济济多士,药学专攻。存心以仁,任事以诚。愿与各位医药同仁互相学习,共同进步。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57