非酒精性脂肪性肝炎(NASH)也称代谢性脂肪性肝炎,是非酒精性脂肪肝病(NAFLD)的一种严重形式,更严重者会发生肝硬化和肝细胞癌。
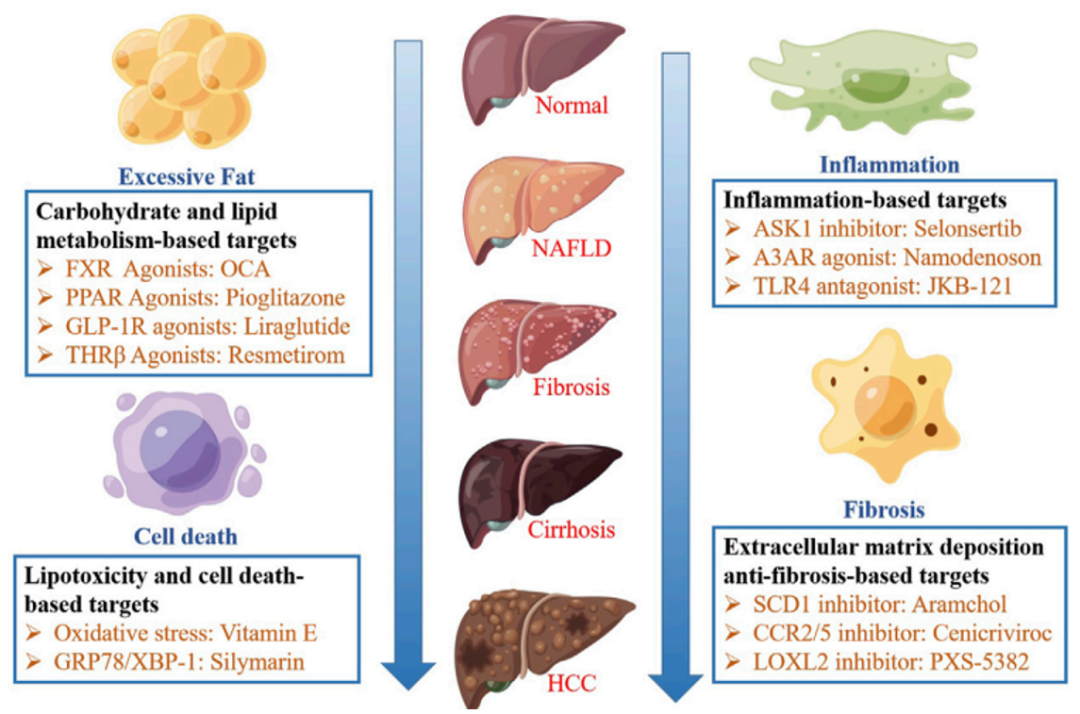
NAFLD的发病机制尚未完全阐明,治疗靶点可分为四类:基于碳水化合物和脂质代谢、基于脂质毒 性和细胞死亡、基于炎症和基于细胞外基质沉积抗纤维化的靶标。
目前,尚无获FDA或NMPA批准治疗NASH的药物,但是临床上有很多不同类型的在研NASH药物,根据靶点主要可以分为以下几类:FXR激动剂、THR-β激动剂、GLP-1R激动剂、PPAR激动剂、FGF19和FGRF21类似物,以及FASN抑制剂等。
Intercept的奥贝胆酸是进展最快的FXR激动剂类NASH药物,但是它的上市申请于6月份被FDA拒绝。(相关文章传送门:再度折戟:奥贝胆酸又遭FDA拒绝批准!百亿美金NASH市场,国内研发版图几何?)不过,近期THR-β激动剂Resmetirom的上市申请获FDA受理且纳入优先审评,如若获批将会给广大NASH患者带来新的希望。
01
NASH的形成及药物类型
非酒精性脂肪性肝病(NAFLD)是一种肝 脏疾病,包括弥漫性非酒精性肝脂肪变性、非酒精性脂肪性肝炎(NASH)和其他肝损伤特征,如肝硬化和肝细胞癌(图1)[1]。NAFLD的定义是超过5%的肝细胞中存在脂肪变性,并且没有过量饮酒(男性每天≥30克,女性每天≥20克)或其他慢性肝病。
此外,如果脂肪变性伴有炎症和肝细胞气球形成,则可能发生NASH。近年来,NAFLD患病越来越普遍,是许多国家慢性肝病的主要原因。NAFLD的全球患病率约为25.2%,NASH的总体患病率约为1.5%-6.5%。肥胖的人更容易患上NAFLD,大约50%和80%的NAFLD和NASH患者超重。2型糖尿病(T2DM)患者的ΝAFLD患病率也很高(56%–59%),T2DM患者中NASH的患病率为37%。
NAFLD的发病机制尚未完全阐明,然而,肥胖、T2DM和其他代谢紊乱因素在增加 NAFLD的发病率和患病率方面起着关键作用。
目前,尚无获FDA或NMPA批准治疗NASH的药物,不过国内外有很多药企纷纷加入布局NASH药物研发,类型多样,作用于不同靶点,包括FXR、THR-β、GLP-1R、PPAR和FASN等(图1)[1]。
02
FXR激动剂
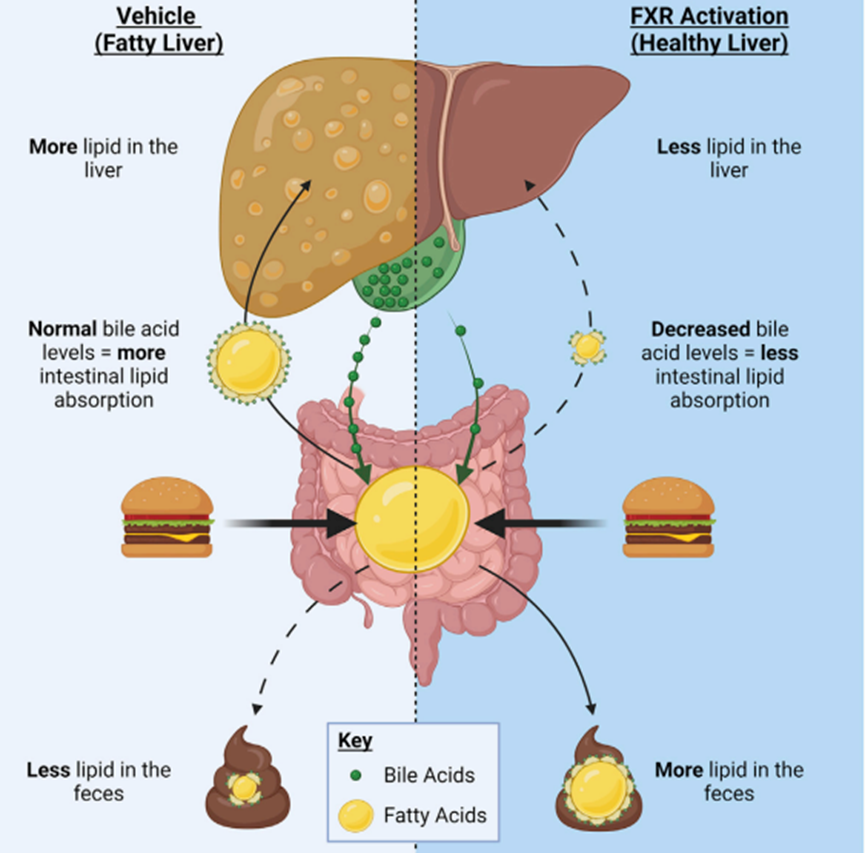
FXR被胆汁酸内源性激活,在肝细胞和小肠细胞中高表达,控制胆汁酸代谢的各个方面,包括合成、输出到胆管和从肠道吸收。FXR控制胆汁酸合成途径的抑制臂,从而升高胆汁酸水平激活FXR,导致在负反馈回路中抑制参与胆汁酸合成的肝基因。
核受体FXR降低肝 脏甘油三酯,以防止NAFLD的发病。Clifford等人证明FXR的激活,通过两种不同的机制降低肝 脏甘油三酯:
1. 通过胆汁酸依赖性降低肠道脂质吸收;
2. 通过脂肪生成的选择性变化(图2)[2]。
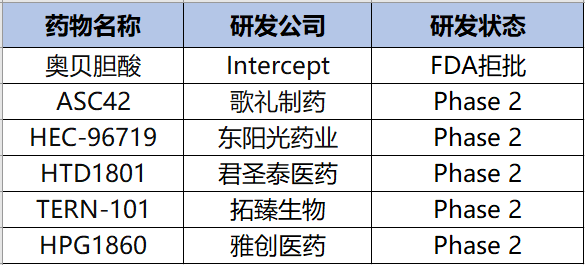
奥贝胆酸(Obeticholic acid)是由Intercept研发的一款特异性FXR激动剂,此前是全球进展最快的用于治疗NASH的FXR激动剂药物。然而今年6月22日,FDA因奥贝胆酸相对安慰剂疗效不够显著且副作用明显而拒绝批准其上市申请,受挫后,Intercept决定停止所有与NASH相关的投资,重组公司业务以加强其对罕见和严重肝 脏疾病的关注。
除此之外,临床上还有很多在研的治疗NASH的FXR激动剂,如歌礼制药的ASC42、东阳光制药的HEC-96719和雅创医药的HPG1860等(图3)。
ASC42
ASC42是由歌礼制药自主研发的新型高效选择性非甾类FXR激动剂,用于NASH和慢性乙型肝炎(CHB)治疗。ASC42于2020年10月获得FDA批准在NASH患者中开展临床试验,随后12月份被FDA授予治疗NASH快速通道资格,目前处于临床2期。
HEC-96719
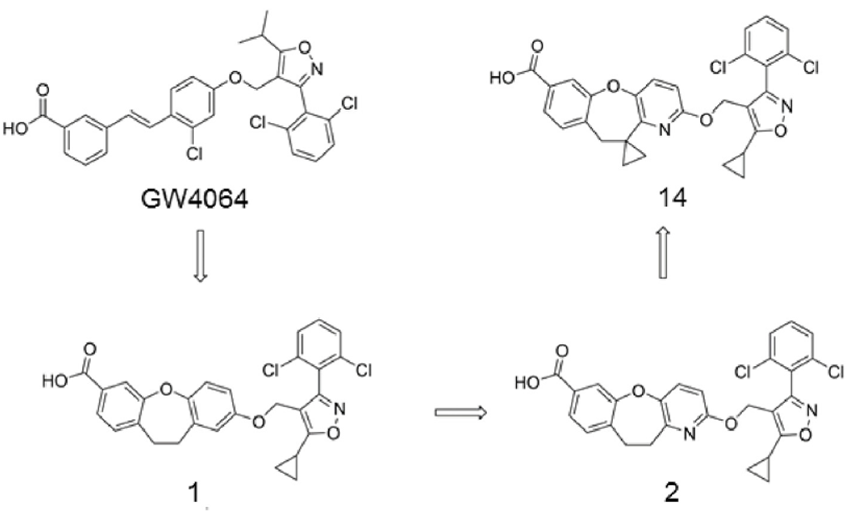
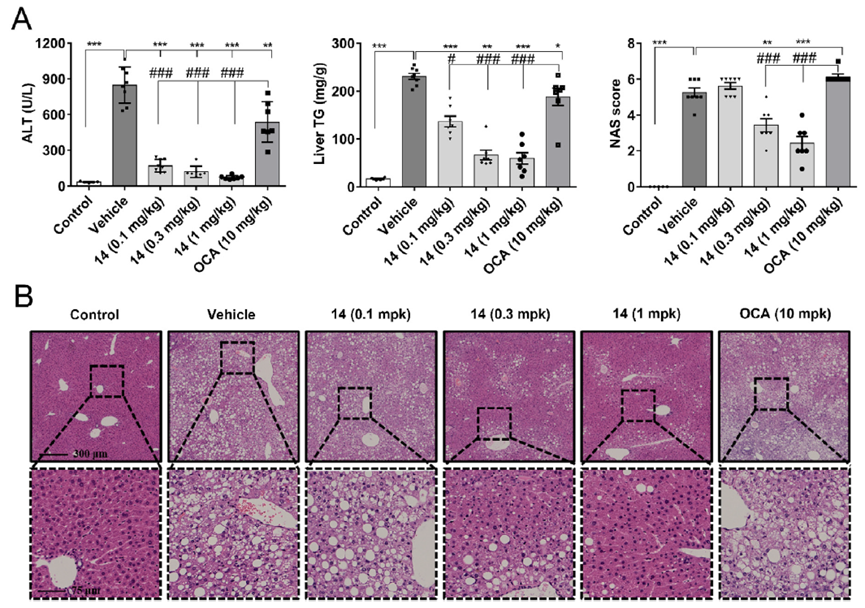
Cao等人在EJMC上报道了HEC-96719(14)的设计合成以及治疗NASH的效果。他们从GW4064开始经过结构优化得到化合物1,进一步优化最终得到化合物HEC-96719(14)(图4)[3]。
口服给药0.1 mg/kg,0.3 mg/kg,1 mg/kg化合物HEC-96719导致血清ALT和肝 脏TG 水平显著降低(图5A),HEC-96719改善NASH似乎是以剂量依赖性方式(图5A和B),HEC-96719目前处于临床2期。
03
THR-β激动剂
甲状腺激素受体β亚型(THR-β)在人体肝 脏中高表达,能够调节脂代谢,有降低血脂和肝脂的作用。与此同时,THR-β还可以通过促进脂肪酸的分解和刺激线粒体的生物发生,来减少脂肪毒 性并改善肝功能,进而减少肝 脏脂肪。因此,THR-β激动剂具备调控多种肝 脏代谢通路来治疗NASH的潜力。
Resmetirom是由Madrigal Pharmaceuticals研发的每日一次的口服甲状腺激素受体(THR)β选择性激动剂,旨在针对治疗肝 脏NASH的关键潜在因素。
9月13日,该公司宣布FDA已接受其Resmetirom的新药申请(NDA)审查,用于治疗患有肝纤维化的成年NASH患者。FDA已授予优先审查,处方药使用者费用法案日期(PDUFA)是2024年3月14日。Resmetirom由18项临床研究组成支持NDA:12项I期研究,2项II期研究和4项III期研究[4]。
Madrigal目前正在进行四项III期临床试验,以证明Resmetirom治疗NASH的安全性和有效性:MAESTRO-NASH,MAESTRO-NAFLD-1,MAESTRO-NAFLD-OLE和MAESTRO-NASH-OUTCOMES。
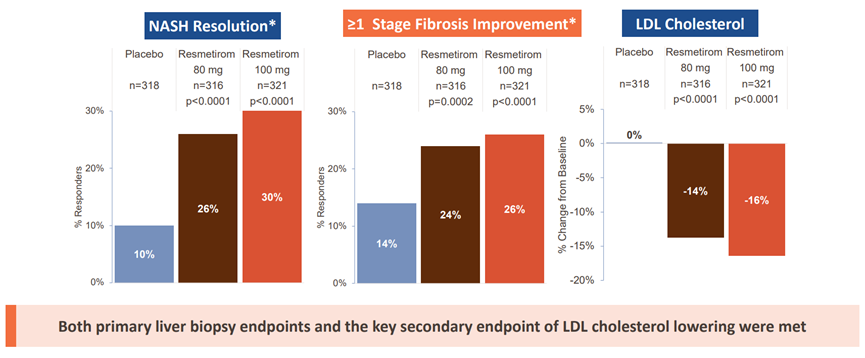
MAESTRO-NASH是一项多中心、随机、双盲、安慰剂对照的Resmetirom的III期研究。该研究旨在支持H亚部分批准招募了1,000多名活检证实的NASH伴纤维化患者,按1:1:1随机分配到每天接受一次Resmetirom 80mg,Resmetirom 100mg或安慰剂。活检的双重主要替代终点是NASH消退,NAS(NAFLD活动评分)降低≥2分,治疗52周后纤维化没有恶化或纤维化减少1分,NAS没有恶化。
2022年12月,Madrigal宣布每日口服剂量的Resmetirom均达到MAESTRO-NASH 初级肝活检终点。还实现了多个次要终点,包括与安慰剂相比,Resmetirom在致动脉粥样硬化脂质和脂蛋白、肝酶、纤维化生物标志物和影像学检查中显著降低(图6)[5]。
Resmetirom在80mg和100mg剂量下通常是安全的,耐受性良好。与先前的II期和III期数据一致,与安慰剂相比,Resmetirom组报告的最常见不良事件频率更高,即治疗开始时一般轻度和短暂性腹泻、恶心过多。
参加MAESTRO-NASH的患者(总入组人数约1,750人)在最初的52周治疗期后继续接受治疗长达54个月,以累积和测量肝 脏临床结果事件,包括活检进展为肝硬化(52周和54个月)和肝失代偿事件,以及全因死亡率。该研究的这一部分旨在产生验证性数据,如果呈阳性,将有助于验证Resmetirom的临床益处并支持完全批准。
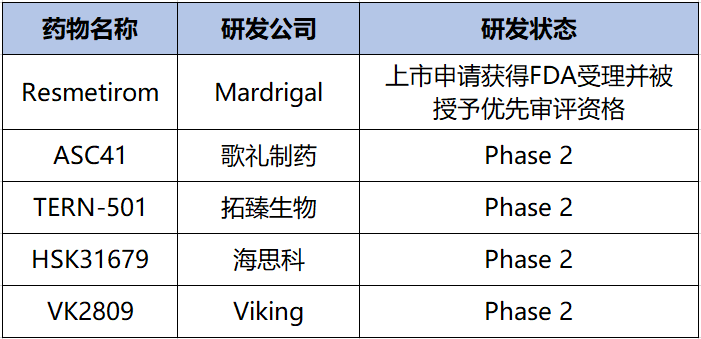
除此之外,临床上还有很多在研的用于治疗NASH的THR-β激动剂药物,如歌礼制药的ASC41、拓臻生物的TERN-501和Viking的VK2809等(图7)。
ASC41
ASC41是歌礼自主研发的一款肝 脏靶向性前体药物,其活性代谢产物可选择性激活THR-β。2022年10月初,ASC41的52周入组肝穿活检证实NASH患者的II期临床试验完成首例患者入组,全部患者入组预计于2023年第三季度底完成。
04
GLP-1R激动剂
GLP-1类药物因其显著的降糖减重效果而备受关注,随着研究的深入,人们发现GLP-1类药物也能治疗NASH。
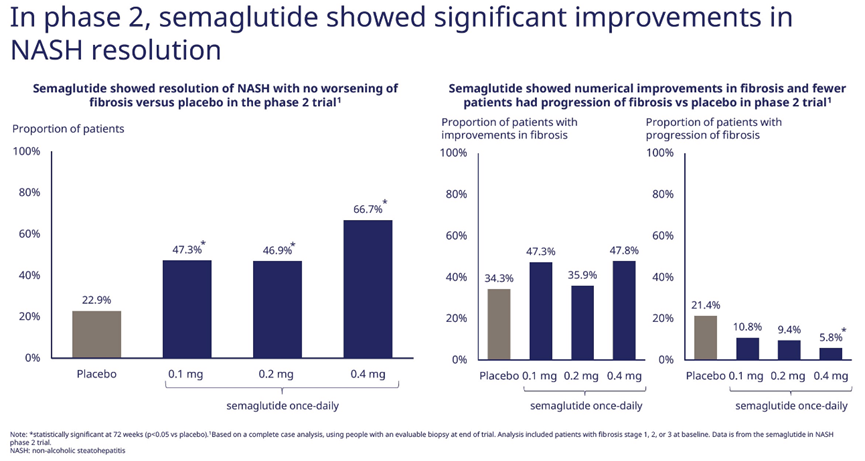
目前进展最快的治疗NASH的GLP-1类药物是司美格鲁肽,处于临床III期。司美格鲁肽在治疗NASH的II期临床结果显示,司美格鲁肽0.1 mg、0.2 mg和0.4 mg治疗组分别有47.3%、46.8%和66.7%的患者的NASH症状得到消除;在改善患者肝纤维化方面,与安慰剂组的21.4%患者肝纤维化出现进展相比,司美格鲁肽0.4 mg治疗组仅有5.8%患者肝纤维化出现进展(图8)[6]。
司美格鲁肽2.4 mg治疗NASH的一项3a期ESSENCE临床于2021年第一季度开启,招募了1200名患者,分为两个部分,Part 1进行72周,Part 2进行240周,预计根据Part 1和临床II期的结果来提交该适应症上市申请(图9)。

除了司美格鲁肽之外,临床上还有很多在研的GLP-1类药物用于治疗NASH,包括礼来的Retatrutide和替尔泊肽、默沙东的Efinopegdutide和阿斯利康的AZD9550等(图10)。
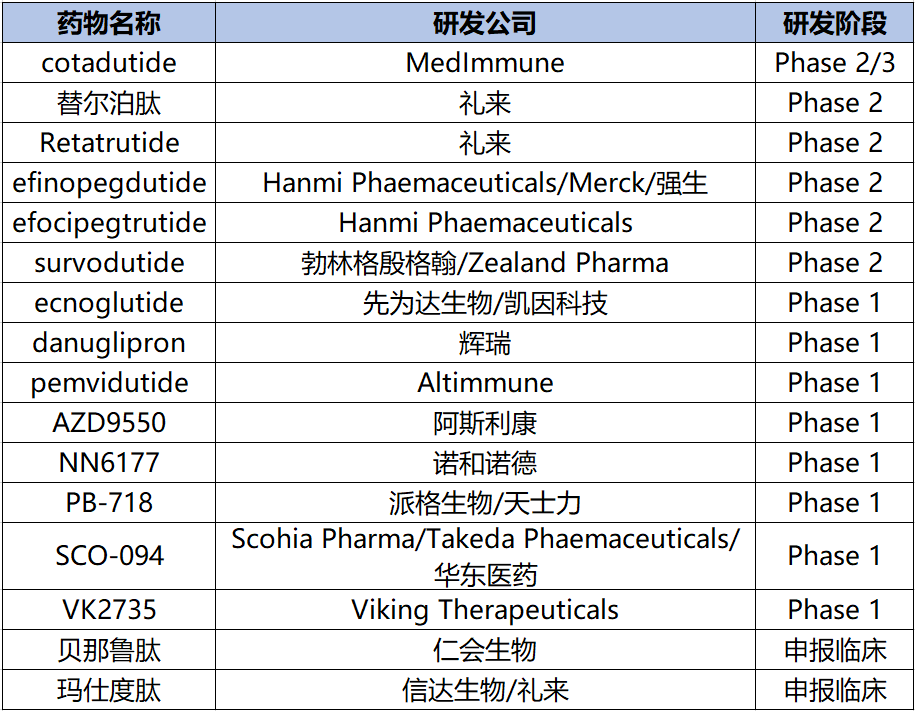
Retatrutide是由礼来研发靶向葡萄糖依赖性胰岛素性多肽(GIP)、GLP-1和胰高血糖素(GCG)受体的三重激动剂。(相关文章传送门:全球首 个GLP-1R/GIPR/GCGR三靶点激动剂来袭,GLP-1 3.0版本时代开启!)
Arun J. Sanyal等人在美国糖尿病协会第83届科学会议(ADA 2023)上报道了retatrutide治疗NAFLD患者的一项临床II期试验。该试验亚组分析的主要和关键次要目的是评估与安慰剂相比肝 脏脂肪的相对变化,以及在第24周时肝 脏脂肪相对减少30%或更多、50%或更多和70%或更高的患者比例。研究人员还计划评估达到NAFLD消退(肝 脏脂肪含量低于5%)的患者比例。
经分析,研究结果显示相对肝 脏脂肪的逐步剂量依赖性减少,使用retatrutide 8 mg和12 mg在第24周分别减少81.4%和82.4%,而安慰剂治疗为0.3%(P < .001)。在第48周,接受8 mg和12 mg retatrutide患者的肝 脏脂肪相对减少81.7%和86%,安慰剂治疗为4.6%[7]。
05
其它类型的NASH药物
除了上述治疗NASH药物类型,还有很多不同机制的NASH药物,包括成纤维细胞生长因子21(FGF21)类似物、FASN抑制剂和PPAR激动剂等(图11)。
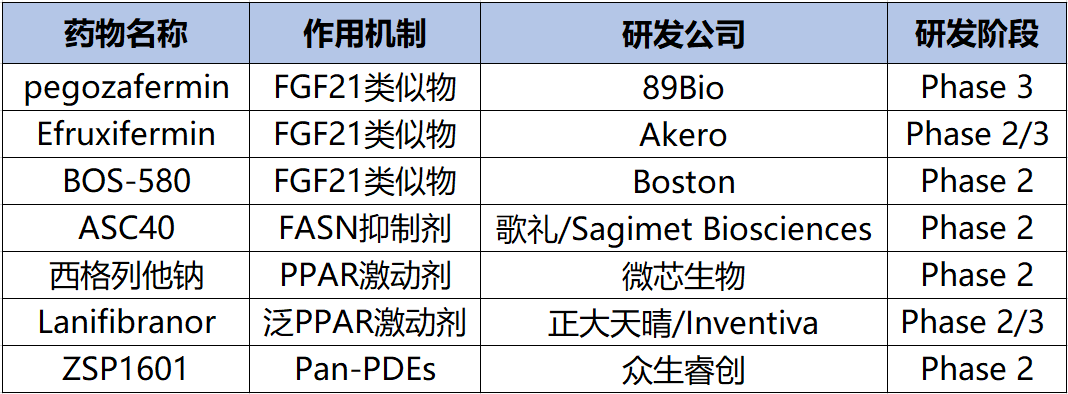
ASC40
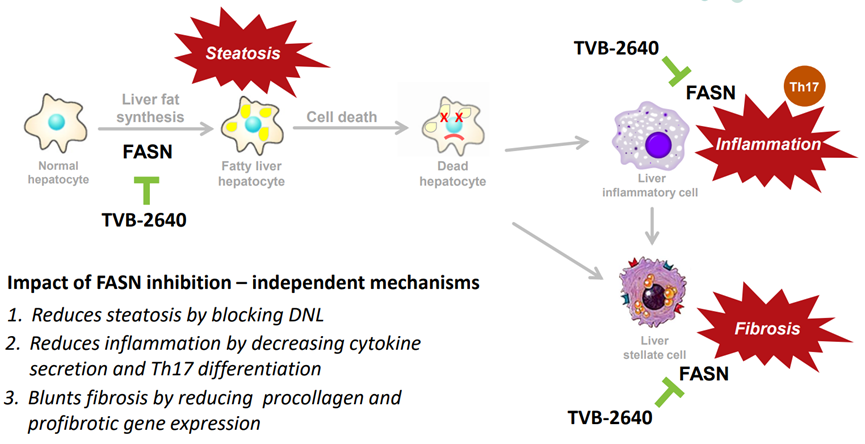
ASC40是歌礼制药一种口服、选择性的脂肪酸合成酶(FASN)抑制剂。FASN抑制剂通过阻断DNL减少脂肪变性、减少细胞因子来减少炎症分泌和Th17分化,以及减少前胶原和促纤维化基因表达钝化纤维化来治疗NASH(图12)[8]。
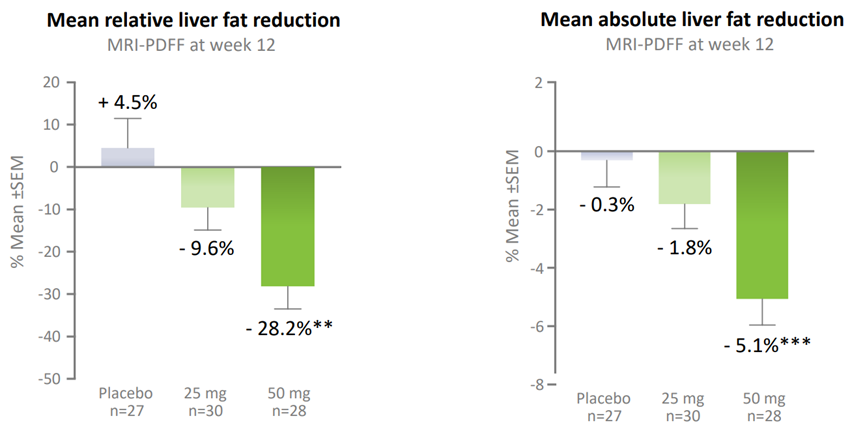
此前,ASC40的一项临床2a期FASCINATE-1试验达到主要疗效终点,有效、剂量依赖性地减少肝 脏脂肪(图13)。FASCINATE-1是多中心、随机、安慰剂对照试验,将99名受试者按1:1:1随机分配给25mg、50mg和安慰剂组,每日一次口服给药12周。
06
小结
目前在中国和美国都没有一款针对NASH的药物获批上市,但是全球的患者逐年增加,迫切需要新机制NASH药物来满足临床需求。
NASH药物由于巨大的市场前景而备受关注,很多药企纷纷加入布局,如Madrigal、礼来、诺和诺德、默沙东、阿斯利康、歌礼制药、拓臻生物、东阳光药业和雅创医药等。
6月份,FDA拒绝了FXR激动剂奥贝胆酸的上市申请,但是近期Madrigal的THR-β激动剂Resmetirom的上市申请获得FDA受理并被授予优先审评资格,PDUFA日期为2024年3月14日,给无数NASH患者带来新的希望,Resmetirom能否成为首 款获FDA批准的新机制NASH药物,药渡将持续关注!
参考资料(可上下滑动):
1.Yajie Fu1, Yanzhi Zhou, Linhu Shen, Xuewen Li, Haorui Zhang, Yeqi Cui, Ke Zhang, Weiguo Li, Wei-dong Chen, Shizhen Zhao, Yunfu Li and Wenling Ye, Diagnostic and therapeutic strategies for non-alcoholic fatty liver disease, Front Pharmacol. 2022 Nov 2;13:973366.
2.Bethan L. Clifford et.al, FXR activation protects against NAFLD via bile-acid dependent reductions in lipid absorption, Cell Metabolism 33, 1671–1684
3.Shengtian Cao, Xinye Yang, Zheng Zhang, Junwen Wu, Bo Chi, Hong Chen, Jianghong Yu, Shanshan Feng, Yulin Xu, Jing Li, Yingjun Zhang, Xiaojun Wang, Yan Wang, Discovery of a tricyclic farnesoid X receptor agonist HEC96719, a clinical candidate for treatment of non-alcoholic steatohepatitis, European Journal of Medicinal Chemistry 230 (2022) 114089
4.https://ir.madrigalpharma.com/news-releases/news-release-details/madrigal-pharmaceuticals-announces-nda-acceptance-and-priority
5.https://ir.madrigalpharma.com/static-files/e8a35f47-f841-49d4-9c21-781f41177609
6.https://investor.novonordisk.com/q2-2023-presentation/?page=303
7.https://www.hcplive.com/view/retatrutide-use-could-contribute-to-nafld-resolution
8.https://sagimet.com/wp-content/uploads/2020/09/EASL-2020-AS074-Sagimet-TVB-2640-Phase-2_Rohit-Loomba.pdf
*声明:本文仅是介绍医药疾病领域研究进展或简述研究概况或分享医药相关讯息,并非也不会进行治疗或诊断方案推荐,也不对相关投资构成任何建议。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57