据不完全统计,2023年第三季度FDA共批准14款创新疗法,涉及呼吸系统、中枢神经系统、眼科以及罕见病等治疗领域。
在这些获批的新疗法中,有多个“第一款”,如第一款创新JAK抑制剂;第一款GSK骨髓纤维化合并贫血新药;第一款RSV疫苗用于婴儿预防;第一款治疗成人产后抑郁症的口服药物;第一款创新疗法治疗“石头人症”,20年来首次有阿尔兹海默病新药获完全批准等,这些药物是科研人员不断探索和开发的结果,为患者提供更好的治疗选择的同时,也为所在药企的可持续发展带来新的增量。
7月5款:涉及治疗RSV、AML和眼科领域等
2023年7月FDA批准上市了4个药物,包括:治疗呼吸道合胞病毒(RSV)的单抗、治疗AML的FLT3激酶抑制剂、治疗蠕形螨睑缘炎的滴眼液,Dostarlimab-gxly联合化疗治疗子宫内膜癌,此外FDA完全批准了卫材/渤健联合开发的lecanemab用于治疗阿尔茨海默症(AD)。
7月6日,FDA官网显示卫材/渤健联合开发的lecanemab(商品名:Leqembi)用于AD的加速批准已成功转为完全批准。根据新闻稿,Leqembi是第一款靶向β淀粉样蛋白,且由加速批准转为传统批准的阿尔茨海默病疗法。行业媒体fiercepharma指出,这是20年来FDA首次完全批准的一款阿尔茨海默病药物。

今年1月,FDA基于lecanemab降低患者大脑淀粉样蛋白沉积的效果,加速批准其上市申请,用于治疗阿尔茨海默病。基于加速批准通道获批上市的新药需要进行验证性临床试验,确认它们的临床疗效。6月10日,在FDA外周和中枢神经系统药物咨询委员会上,与会专家以6:0的投票结果一致支持lecanemab基于III期CLARITY AD研究的积极结果获得完全批准。目前,lecanemab的定价为2.65万美元/年。美国医保方曾表态在lecanemab全面批准时可能会考虑扩大覆盖范围。值得注意的是,lecanemab在中国的上市申请已于2022年12月获CDE受理。
7月17日,阿斯利康/赛诺菲共同开发的长效呼吸道合胞病毒(RSV)抗体Beyfortus(Nirsevimab)获FDA批准上市,用于预防RSV引起的下呼吸道疾病(LRTD)。该药物适用于新生儿和在第一个RSV季节出生或进入第一个RSV季节的婴儿,以及在第二个RSV季节仍易患严重RSV疾病的24个月以下儿童。Beyfortus将在即将到来的2023-2024 RSV流行季之前在美国上市。
7月20日,第一三共宣布,FDA已批准Vanflyta(quizartinib)治疗新诊断FLT3-ITD阳性的AML成人患者的上市申请,该药物可联合用于标准的阿糖胞苷+蒽环类药物的诱导缓解治疗和阿糖胞苷巩固治疗,以及单药用于巩固后的持续治疗。根据新闻稿,Vanflyta是第一个获得美国FDA批准用于AML患者三个治疗阶段(诱导、巩固和维持治疗)的FLT3抑制剂。
7月25日,FDA批准了Tarsus Pharmaceuticals的Xdemvy,使得患有蠕形螨眼炎的人现在有了新的治疗选择。Xdemvy是一种处方眼药水,旨在根除这种疾病的根本原因——蠕形螨。

Xdemvy是第一款获批用于治疗蠕形螨眼炎的药物。Xdemvy的批准是基于两项随机、多中心、双盲、载体对照的研究,共有833名患者,其中415名患者接受了治疗。Tarsus Pharmaceuticals在其批准公告中表示,到第43天,每项研究都有显著改善,并补充该疗法“总体上是安全且耐受性良好的”。根据Tarsus Pharmaceuticals的数据,由于蠕形螨性眼炎影响了美国约2500万人,占所有眼炎病例的三分之二以上,因此Xdemvy有望迎来可观的市场。
7月31日,GSK宣布,FDA已批准其PD-1抑制剂Jemperli(dostarlimab)与卡铂和紫杉醇联合用药,并接续Jemperli作为单药以治疗由美国FDA批准的检测方法确定为错配修复缺陷型(dMMR)或高度微卫星不稳定性(MSI-H)的原发性晚期或复发性子宫内膜癌成人患者。根据新闻稿,Jemperli是第一个获批与化疗联合用于该患者群体一线治疗的免疫肿瘤疗法。Jemperli是一种抗pd -1抗体,于2021年4月首次被批准用于复发或晚期dMMR子宫内膜癌。FDA于6月6日接受了补充BLA,将该药推向一线。
8月7款:辉瑞、杨森、再生元和渤健等大药企主导
2023年8月,FDA批准7款新药,分别为治疗年龄相关性黄斑变性继发的地理性萎缩药品Izervay(avacincaptad pegol)、治疗多发性骨髓瘤药物Talvey(talquetamab-tgvs)、治疗多发性骨髓瘤药物Elrexfio(elranatamab-bcmm)、治疗骨化性纤维发育不良药品Sohonos(palovarotene)等等。
2023年8月5日,Iveric Bio宣布FDA批准其核酸适配体药物Avacincaptad pegol上市,用于治疗地图样萎缩,商品名为Izervay。

2023年4月,安斯泰来以59亿美元收购Iveric Bio,此次Avacincaptad pegol获批,意味着地图样萎缩(GA)迎来新的潜在重磅创新药。
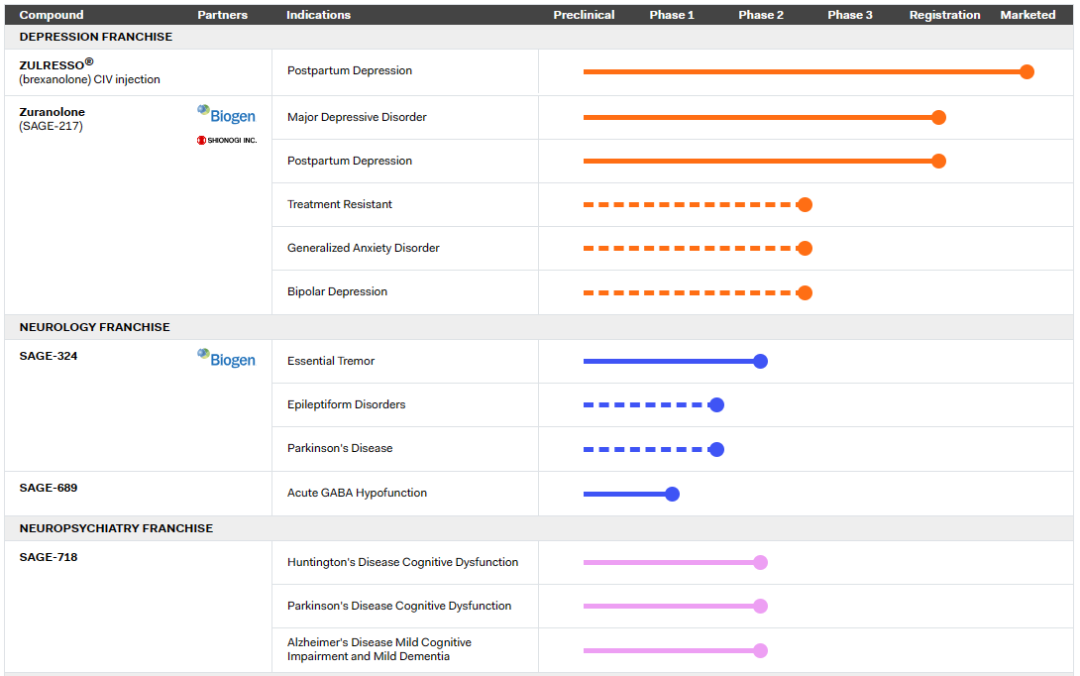
2023年8月5日,美国FDA批准由Sage Therapeutics和渤健共同开发的潜在重磅药物Zurzuvae(zuranolone)上市,使其成为第一个获批用以治疗产后抑郁症(PPD)成人患者的口服疗法。在此之前,PPD患者的治疗仅可通过医护人员在医疗机构通过静脉注射给药。Zurzuvae是一种每日一次、为期两周的口服疗法,设计用于治疗抑郁症(MDD)和PPD。
Sage Therapeutics是一家生物制药公司,致力于开发具有改变大脑衰弱性疾病患者生活潜力的新疗法。研发管线涉及抑郁症、神经病学和神经精神病学等大脑疾病。
2023年8月10日,杨森宣布,FDA已加速批准Talvey(talquetamab-tgvs)用于治疗复发性或难治性多发性骨髓瘤成人患者。Talvey是一款GPRC5D/CD3双特异性T细胞结合抗体,可结合T细胞表面表达的CD3受体和G蛋白偶联受体家族C组5成员D(GPRC5D)。GPRC5D在正常人体组织中表达有限,但在恶性浆细胞上高表达,使其成为多发性骨髓瘤(MM)患者有希望的免疫治疗靶点。
8月14日,辉瑞宣布其研发的CD3/BCMA双抗ELREXFIO(elranatamab)获FDA加速批准上市,用于治疗复发或难治性多发性骨髓瘤(R/R MM),这些患者既往至少接受过四种治疗,包括蛋白酶体抑制剂、免疫调节剂和抗CD38单克隆抗体。这也是继强生Tecvayli(teclistamab-cqyv)后,第二款获FDA批准上市的CD3/BCMA双抗。
2023年8月17日,益普生宣布美国FDA已批准Sohonos(palovarotene)上市,用于在进行性肌肉骨化症(FOP)患者中降低新骨化组织的产生。适用人群为FOP成人患者,8岁以上的女性儿童患者和10岁以上的男性儿童患者。新闻稿指出,Sohonos是FDA批准第一个治疗FOP的药物。进行性肌肉骨化症的一个俗称是“石头人症”,意指随着疾病的发展,人会像石头一样无法活动。这一罕见病的主要症状是人体中原本柔软、有弹性的肌肉和结缔组织会在轻微受伤后就出现炎症,并且会变成骨骼,将原本可以自由活动的关节锁死在一个位置上。
2023年8月18日,再生元宣布,FDA批准C5抗体Veopoz (pozelimab-bbfg)用于治疗1岁及以上的CHAPLE病(也称为cd55缺陷蛋白丢失性肠病)成人和儿童患者。据新闻稿,Veopoz是第一个也是唯一一个针对CHAPLE的疗法。Veopoz是一种IgG4全人源单克隆抗体,旨在阻断补体因子C5的活性,并预防通过补体途径介导的疾病,并与野生型和变异型人类C5具有高亲和力。

8月21日,辉瑞宣布FDA已批准其二价呼吸道合胞病毒(RSV)疫苗Abrysvo(RSVpreF,PF-06928316)新适应症上市,通过孕妇主动免疫,预防出生至6个月大的婴儿患上RSV相关下呼吸道疾病(LRTD),这是FDA批准的第一款保护婴儿在出生至6个月内免受RSV引起的LRTD和严重LRTD的孕产妇接种疫苗。

今年5月31日,FDA已批准Abrysvo用于预防RSV引起的60岁及以上人群的LRTD,这是全球第2款针对该适应症的RSV疫苗,而全球第一款(GSK3844766A)来自GSK。
9月2款:治疗多发性骨髓和骨髓纤维化
2023年9月,FDA批准2款新药,涉及多发性骨髓瘤干细胞动员和治疗中度或高风险骨髓纤维化方面。
9月11日,BioLineRx宣布,美国FDA已批准Aphexda(motixafortide)联合filgrastim(粒细胞集落刺激因子G-CSF)动员造血干细胞至外周血,以作为多发性骨髓瘤患者在移植时促进患者自体移植的干细胞动员(SCM)。

根据新闻稿,Aphexda是十年来第一个在多发性骨髓瘤干细胞动员方面获得FDA批准的创新药物。

据BioLineRx官网介绍,其主要资产motixafortide是一种创新的高亲和力CXCR4抑制剂。这种新型药物利用CXCR4受体在多种细胞群中的表达,包括造血干细胞、免疫细胞和癌细胞,使其潜在地适用于多种适应症,如干细胞动员和抗肿瘤治疗。
9月15日,GSK宣布FDA批准Ojjaara(momelotinib)上市,用于治疗中度或高风险骨髓纤维化,包括原发性骨髓纤维化或继发性骨髓纤维化(真性红细胞增多症和原发性血小板增多症)成人贫血患者。

根据新闻稿,Ojjaara是第一个也是唯一适用于骨髓纤维化合并贫血患者的治疗方法,Ojjaara开始由Sierra Oncology开发,2022年7月GSK以约19亿美元的价格收购该公司并获得这款产品。
总 结
从上述获批创新疗法来看,辉瑞、渤健和GSK等跨国大药企收获相对较多,小药企占比较少。FDA是全球新药审批的风向标,上述在各个治疗领域新药的获批,给予了同类产品研发企业信心,同时也为患者提供了更多治疗选择。尤其是20年来首次有阿尔兹海默病新药获FDA完全批准,这无疑给AD药物研发企业巨大信心。对于获批的新疗法,国内药企可以适当参考借鉴,结合自身情况调整研发方向。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57