近日中国国家药监局药品审评中心(CDE)官网公示,科伦博泰TROP2 ADC注射用SKB264联用PD-L1单抗KL-A167注射液,适应症用于不可手术切除的局部晚期、复发或转移性HR+/HER2-乳腺癌的治疗;开拓药业Hedgehog/SMO抑制剂GT1708F片,拓展适应症特发性肺纤维化,上述三款产品均获得临床默示许可。
SKB264联用KL-A167
SKB264(MK-2870)是一款新型TROP2 ADC,科伦博泰自主研发的核心产品,抗体部分hRs 7(humanized IgG1),payload为TopoI抑制剂T030(贝洛替康衍生物),DAR值7.4。
根据科伦博泰公告,2023年8月SKB264用于治疗既往经二线及以上标准治疗的不可手术切除的局部晚期、复发或转移性三阴性乳腺癌(TNBC)患者的随机、对照、开放性、多中心3期临床试验已达到主要研究终点。根据期中分析结果,科伦博泰计划就提交NDA事宜与CDE进行沟通
此前SKB264已3次被CDE纳入突破性疗法,适应症分别为:三阴性乳腺癌、EGFR突变非小细胞肺癌、HR+/HER2-乳腺癌。
既往临床数据
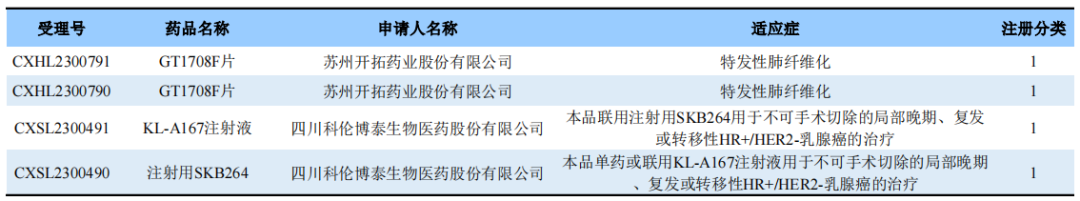
EGFR突变NSCLC末线治疗
2023年ASCO公布了SKB264用于EGFR突变NSCLC患者末线治疗的研究数据。结果显示,在39名可进行疗效评估的患者中,SKB264的ORR达到43.6%,DCR为94.9%,中位DoR为9.3个月。对于EGFR野生型亚组(既往接受包括抗PD-(L)1治疗在内的中位2线治疗),ORR为26.3%,DCR为89.5%,中位PFS为5.3个月。在TKI耐药的EGFR突变NSCLC亚组(一线化疗失败患者占50%)中,ORR为60.0%,DCR为100%,中位PFS为11.1个月。
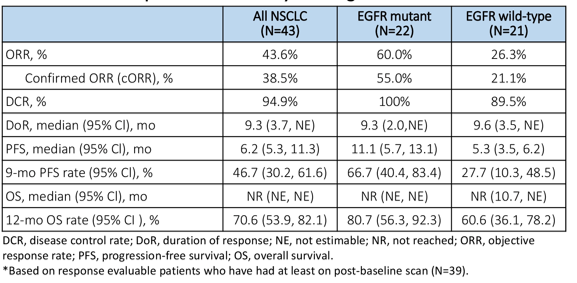
SKB264联用PD-1一线治疗TNBC
根据科伦博泰招股书,在一项2期临床中,SKB264联合PD-1单抗A167用于一线治疗三阴性乳腺癌患者,截至2022年12月底,在7名疗效可评估的患者中,6名患者出现PR,ORR为86%。
相关交易
SKB264海外权益授权给默沙东,科伦博泰获得首付款4700万美元以及总额最高可达3.8亿美元的研发里程碑付款及7.8亿美元的销售里程碑付款,并获得比例从中个位数到低双位数不等的分级销售分成。
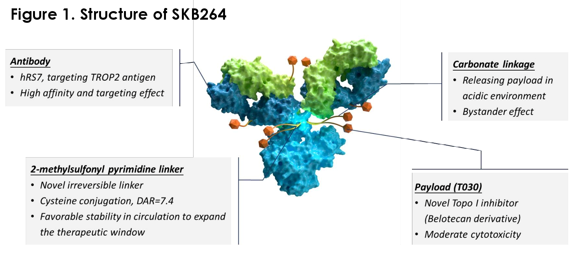
GT1708F片
GT1708F是开拓药业从苏州云轩收购所得产品,是一款具有高活性和高特异性的SMO蛋白抑制剂,此前已开展了血液瘤方向的1期临床研究。本次临床默示许可预计是将开展GT1708F片治疗特发性肺纤维化的中国II期临床试验。
特发性肺纤维化(IPF)是一种慢性、进行性、纤维化的间质性肺疾病,是间质性肺疾病中最为凶险的疾病之一,患者诊断后中位生存期仅为3-5年,被称为“不是癌症的癌症”,全球NASH患病人群中,约有40.8%的患者向肝纤维化进展,然后逐步发展为肝硬化甚至肝癌,尚无有效改善纤维化指标的有效药物。
既往临床数据
公司公告显示,I期(CTR20201525)临床研究共纳入18例患者,包括15例AML患者和3例骨髓增生异常综合征(MDS)患者,剂量及入组人数分别为20mg每日一次(QD)(1例)、40mg QD(1例)、80mg QD(4例)、120mg QD(3例)、180mg QD(3例)、240mg QD(3例)以及320mg QD(3例)。
结果显示,在剂量递增阶段,自180mg剂量组起,在多线治疗失败的急性骨髓性白血病(AML)患者中观察到初步疗效,AML患者髓系原始细胞较基线最高下降了62%。所有患者均未发生剂量限制性毒 性(DLT)和与研究药物有关的严重不良事件(SAE)。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57