根据CDE官网2023年9月19日公示,辉瑞自免领域1类新药JAK1抑制剂阿布昔替尼片被纳入拟优先审评品种。拓展适应症:对其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的难治性、中重度特应性皮炎(AD)12岁及以上青少年患者。
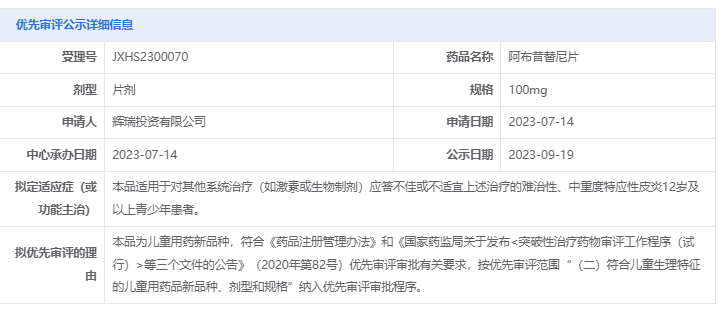
此次拓展适应症申报上市时基于一项名为JADE TEEN的III期临床研究。本项研究是一项针对青少年群体特应性皮炎患者的随机、双盲、安慰剂对照的临床试验,共入组287名患者,旨在评估阿布昔替尼(100mg或200mg,QD)在中度至重度AD青少年(12至<18岁)患者中的有效性和安全性。研究的主要终点为第12周时IGA为0/1的患者比例、在第75周达到EASI-75应答的患者比例、以及PP-NRS4患者比例。
研究结果显示:阿布昔替尼100mg或200mg每日一次治疗组中第12周时达到IGA或EASI-75 应答的受试者比例显著高于安慰剂组。
注:EASI=湿疹面积和严重程度指数;IGA=研究者整体评估;
IGA应答定义为IGA评分达到清除(0)或几乎清除(1)(5分制量表)且相对于基线下降≥2分。
EASI-75应答定义为EASI相对于基线的改善≥75%
PP-NRS4应答者是指PP-NRS相对于基线改善≥4分的受试者。
阿布昔替尼片2022年4月已获得NMPA批准上市,商品名希必可,治疗中度至重度特应性皮炎成人患者。产品上市之初价格3150/盒(规格为100mg*14片),2023年年初进入国家医保,进入医保后价格已经调整为1092元/盒。
阿布昔替尼在中重度特应性皮炎成人患者中的关键性临床研究,展现了良好的临床优势。
阿布昔替尼 vs IL-4R单抗度普利尤单抗
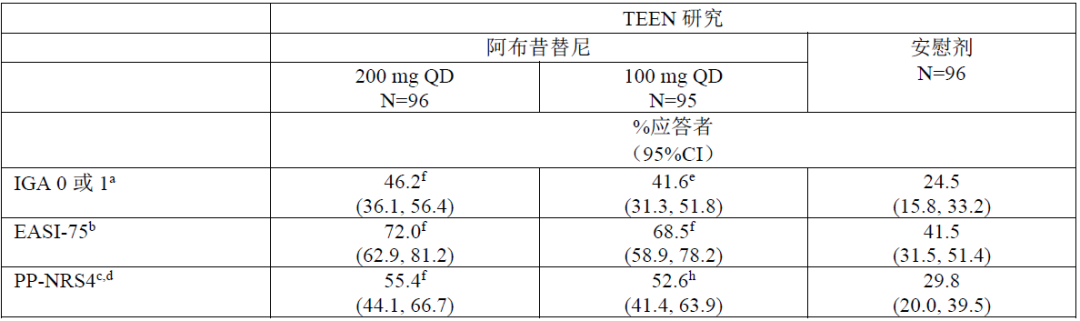
JADE COMPARE研究表明,使用阿布昔替尼的组别相对度普利尤单抗组治疗中重度特应性皮炎效率更高、速度更快。
主要临床终点
第12周IGA0/1应答率:48.4%,36.6%,36.5%,14.0%;
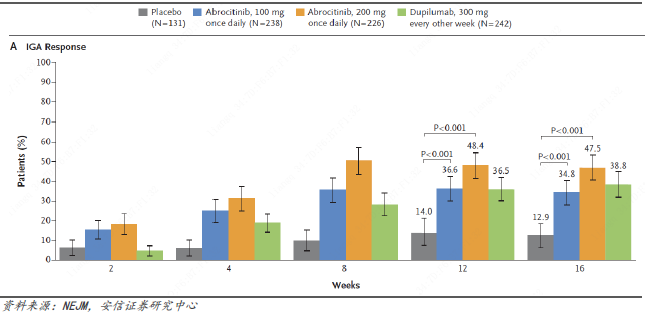
第12周EASI-75应答率:70.3%,58.7%,58.1%,27.1%。
注:上述结果分别对应阿布昔替尼200mg,阿布昔替尼100mg,度普利尤单抗,安慰剂。
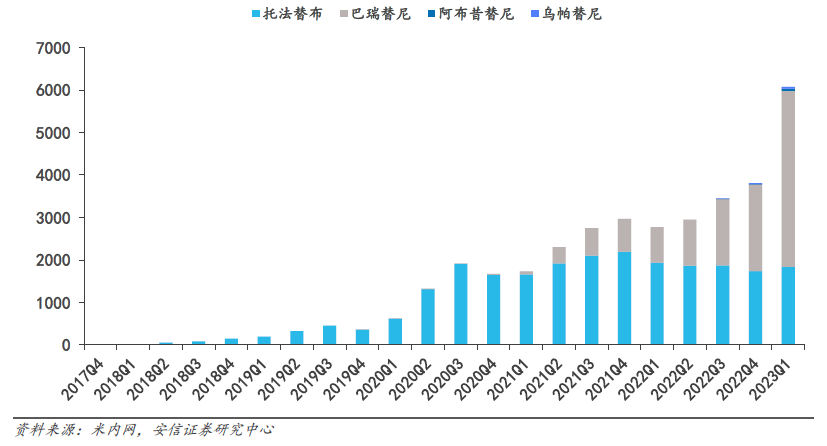
根据药渡数据检索目前国内自免领域已获批四款进口JAK抑制剂,具体信息如下:
自免领域国内已获批上市进口JAK 抑制剂
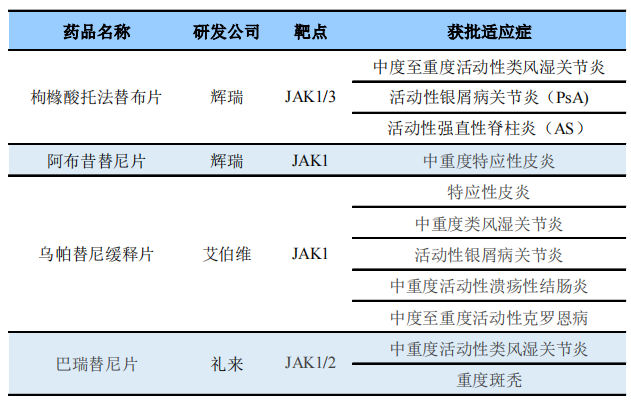
米内网数据显示,2022年进口JAK抑制剂样本医院销售规模达1.3亿元,其中托法替布由于2020年仿制药上市停止增长,巴瑞替尼增长迅速,2023年Q1样本医院销售额达0.4亿元,环比增长约100%。阿布昔替尼目前仍处于放量初期,未来进一步扩展儿童用药人群,市场潜力巨大。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57