
2023年9月1日,全国团体信息平台发布了由上海市毒理学会组织起草的《药物吸入过敏性试验指南》(T/SHSOT 007—2023)团体标准,该标准2023年10月01日起实施。此《药物吸入过敏性试验指南》团体标准适用于经吸入途径给药的化学药物、中药及天然药物等。该指南实施后将成为国内第一个具备操作性强、指导性强的针对药物吸入过敏性评价的指南,能为吸入制剂安全性评价提供基本的技术指导,推动我国自主品牌吸入制剂的发展,满足人们用药需求,保障公众健康,弥补了国内药物吸入过敏性试验领域的空白,为科研人员提供了更多的灵活性和参考依据,从而推动技术的进步和创新。
一、创新型制剂—吸入制剂知多少?
吸入制剂作为一种工艺相对复杂的制剂形式,吸入制剂,系指原料药物溶解或分散于适宜介质中,以气溶胶或蒸气形式递送至肺部发挥局部或全身作用的液体或固体制剂,具有药物起效快、用药量少、局部药物浓度高而全身不良反应少等优点。2020年版《中国药典》将吸入制剂划分为气雾剂、吸入粉雾剂、吸入喷雾剂、吸入液体制剂和可转变蒸汽的制剂等,中国药典常用吸入制剂分类如下图:
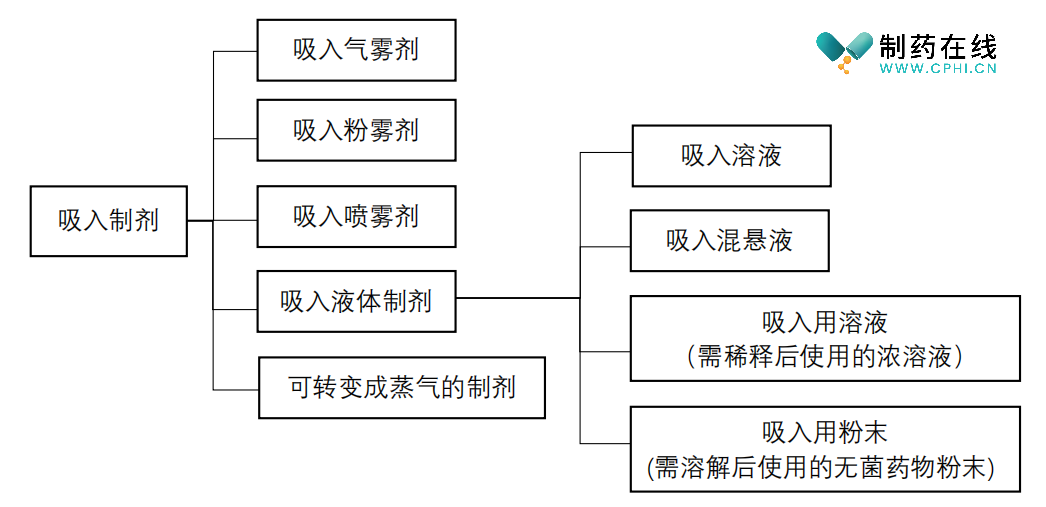
二、《药物吸入过敏性试验指南》标准信息
|
项目 |
内容 |
|
标准号 |
T/SHSOT 007—2023 |
|
中文名称 |
药物吸入过敏性试验指南 |
|
英文名称 |
Guideline for the inhalation anaphylaxis testing of drugs |
|
发布日期 |
2023年09月01日上海市毒理学会发布公告 2023年10月27日全国团体信息平台发布 |
|
实施日期 |
2023年10月01日 |
三、《药物吸入过敏性试验指南》起草单位、起草人和主要技术内容
|
项目 |
内容 |
|
起草单位 |
上海市食品药品检验研究院、益诺思生物技术南通有限公司、浙江大学药物安全评价研究中心、浙江省食品药品检验研究院、昭衍(苏州)新药研究中心有限公司、上海市疾病预防控制中心、上海梅理实验科技有限公司、谛思蔼(上海)贸易有限公司、谱尼测试集团上海有限公司、上海优萃生物科技有限公司、广州市华代生物科技有限公司。 |
|
起草人 |
唐黎明、盛云华、谷舒怡、航艾、胡玥、高楠熊、杨晓春、刘璐、曹瑾、缪文彬、邵乃敏、王宇、张海飞、冯震、孙杰、覃勇长、董新威、匡荣、洪新宇、严佳捷、平丽、程树军、季晓谡、唐玮键、畅俊壮。 |
|
主要技术内容 |
本指南适用于化学药物、中药、天然药物中经雾化吸入途径的制剂。 本指南规定了豚鼠吸入主动全身过敏性试验(ASA)的范围、规范性引用文件、术语和定义、符号和缩略语、试验基本原则、试验方法、试验数据和报告。 |
|
本文件首批执行单位 |
上海市食品药品检验研究院、益诺思生物技术南通有限公司、浙江大学药物安全评价研究中心、浙江省食品药品检验研究院、昭衍(苏州)新药研究中心有限公司、上海市疾病预防控制中心、上海梅理实验科技有限公司、DSI、谱尼检测、上海优萃生物科技有限公司 |
四、吸入制剂过敏性评价原则和方法亮点内容抢先看
吸入疗法被世界卫生组织(WHO)推荐为哮喘、COPD等呼吸道疾病的首选疗法。吸入制剂市场需求量大,应用前景广阔,研究热点备受国内外关注。但是吸入毒 性评价具有特殊要求,难度大,面临诸多挑战,相比口服、静脉注射等常规给药方式其评价难度大大提高。吸入过敏性评价指导原则国内暂无,国外吸入指导原则对吸入急性毒 性和重复给药毒 性有相应的技术指导文件,但未见吸入过敏性试验技术指导原则。吸入新药的开发,迫切需要统一的规范指导行业发展。建立吸入过敏性试验技术标准,力求使吸入制剂评价过程中需要关注的关键问题达成共识,旨在为吸入制剂安全性评价研究过程提供基本的技术指导,研究开发出优质的呼吸系统仿制药和新药,满足临床用药需求,促进和指导行业发展。本标准的建设意义重大而深远。吸入过敏性评价的原则和方法,分为实验动物、暴露方式、暴露参数、暴露频率及周期、暴露条件的监测、指标观察或检测、结果分析及评价七个部分,介绍如下:
1. 实验动物
(1) 动物伦理
遵守国家实验动物相关法律法规和标准,包括但不局限于《实验动物管理条例》、GB/T 42011—2022以及GB/T 35892—2018的要求。实验动物的使用应符合实验动物福利伦理原则,并通过实验动物管理和使用委员会的审查。
(2) 实验动物种属、体重、数量
动物应符合GB/T 34791—2017中对相应等级的要求,并具有实验动物质量合格证。通常选用豚鼠,雌雄各半,雌性未孕,体重300g~400g。通常设立阴性和/或阳性对照组及受试物组,每组动物数至少6只。必要时设立辅料/溶媒对照组。
(3) 饲养环境
1) 实验动物和动物试验的环境设施应符合GB 14925—2010的相应规定。动物房温度应维持在20℃~26℃,相对湿度在40%~70%。
2) 动物常规饲料喂养,自由饮水。饲料各项指标均应符合GB 14924.3—2010、GB/T 14924.2—2001的相应规定。水质应符合GB 5749—2022的相应规定。
3) 动物应分性别饲养,每笼内的动物数量不应影响对每只动物的观察。
(4) 试验前动物准备
试验开始前动物饲养观察至少3日以适应试验环境。试验前将动物随机分组并编号。
2. 暴露方式
根据受试物的特点并且尽可能满足一定暴露量的原则,选择合适的吸入暴露方式,口鼻暴露或全身暴露,尽量减少动物可能承受的痛苦,利于实验人员观察动物症状。暴露方式根据受试物的特点尽可能满足达到一定暴露量的原则,采用利于实验人员观察动物症状的方式选择合适的吸入暴露方式。吸入过敏性评价中致敏和激发采用相同的暴露方式。
3. 暴露参数
暴露参数主要对气溶胶发生、气溶胶浓度测定、气溶胶粒径测定和吸入剂量进行了说明。介绍受试物的分类及其发生,气溶胶浓度的表达及分析方法的选择,气溶胶粒径及测定方法,吸入剂量的表达和吸入过敏性评价中高、低剂量设置的方法。
4. 暴露频率及周期
暴露频率及周期主要对吸入过敏性评价的吸入暴露频率和吸入暴露周期进行说明。吸入过敏性评价的给药频次和周期,基于吸入暴露给药方式,遵循药物刺激性、过敏性和溶血性研究技术指导原则中过敏性试验的相关要求。通常采用吸入暴露的方法,隔日一次,共3次。末次致敏后第14日、21日,分别吸入激发。
5. 暴露条件的监测
暴露条件的监测主要遵循OECD413:Subchronic Inhalation Toxicity:90-Day Study对气溶胶浓度监测、气溶胶粒径监测、暴露装置内气流、暴露系统内环境监测的相关要求,根据吸入过敏性评价的特殊性,对上述特征参数如气溶胶浓度范围的界定,粒径测定方法和频次,环境暴露参数温度,湿度,氧气,二氧化碳监测频次,气体流量监测进行了优化,结合新药过敏性评价综合制定暴露条件各项参数的监测频次。如暴露系统内环境监测参数:口鼻暴露和全身暴露系统都需监测记录动物呼吸区的环境参数,在暴露过程中尽可能连续监测或每小时监测记录1次。染毒柜内温度维持在22℃±3℃,理想的相对湿度一般在30%~70%。氧气的浓度至少为19%,二氧化碳的浓度不超过1%。
6. 指标观察或检测
指标观察或检测主要遵循药物刺激性、过敏性和溶血性研究技术指导原则中过敏性试验过敏反应症状和全身致敏性评价标准来判定受试物的吸入过敏性。包括但不限于体重观察、笼外观察、死亡或濒死动物、过敏症状观察。
7. 结果分析及评价
对动物的全身致敏性反应进行评价。每组试验结果均按下表判断受试物的致敏程度,计算每组过敏反应发生率。过敏反应发生率(%)=发生过敏反应动物数÷每组动物数×100%。全身致敏性评价标准见下表:

参考文献:[1] www.ttbz.org.cn等
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57