11月3日,国家药监局药审中心印发《药品审评中心药物临床试验期间安全信息评估与风险管理工作程序(试行)》(以下简称《工作程序》),共5章12条,并附8个附件。
根据《工作程序》总则第二条:临床试验期间,申办者承担药物临床试验安全风险管理主体责任,开展风险监测、识别、评估和控制,并及时向药审中心报告可疑且非预期严重不良反应(SUSAR)和其他潜在严重安全性风险信息,定期提交研发期间安全性更新报告(DSUR)。申办者发现存在安全性问题或者其他风险,应及时采取风险控制措施,包括一般风险管理措施(如调整临床试验方案等)、主动暂停或者终止临床试验,并向药审中心报告。
药审中心根据申办者提交的安全性报告(信息)及风险管理信息,结合药物临床试验原审评审批情况,进行临床试验风险监测与评估,对于申办者实施风险管理措施不充分的情形,将提出进一步的风险控制要求,如风险管理告知、一般风险管理措施、责令暂停临床试验和终止临床试验等。
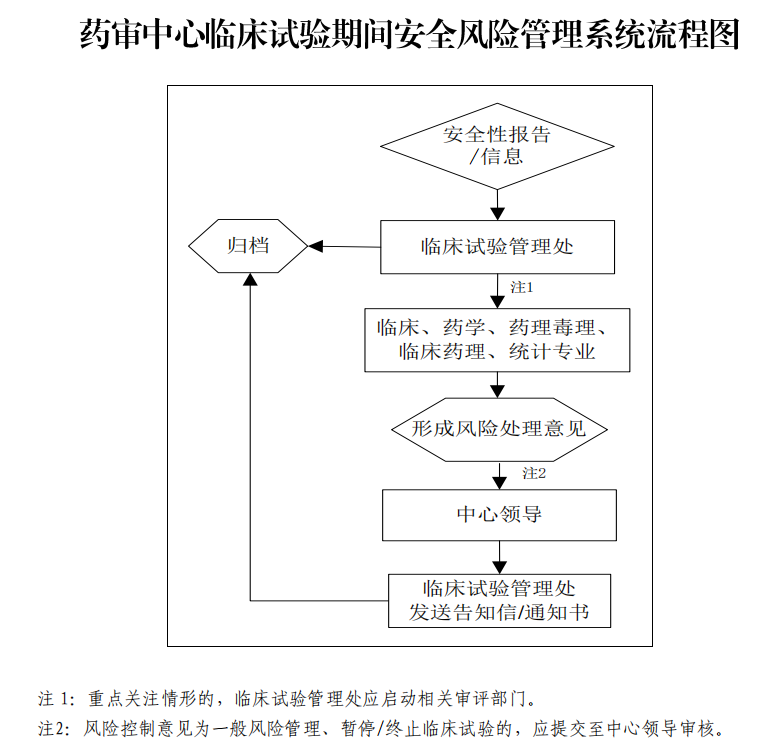
此外,《工作程序》附有临床试验期间安全风险管理系统流程,具体如下:



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57