11月1日,FDA公布了一则召回信息,非常严重的是所有批次的眼科制剂,全部召回。

原因是调查人员在生产设施中发现污染,而且在药物生产环境采样中发现微生物检测呈阳性。这样的结果对眼科用药来说,可能导致无菌眼科药品不合格,在治疗时反而引入新的污染物造成二次伤害。毕竟直接经由眼部用药,会绕过身体的自然防御。这次虽然是调查后发现生产设施和环境的问题而召回,但最开始则是因为三起不良反应报告。初步推测可能是不良反应有报告后,相关部门协同调查,从而发现是整个生产状态的系统问题,这算是不良反应上报制度的一次发挥作用。
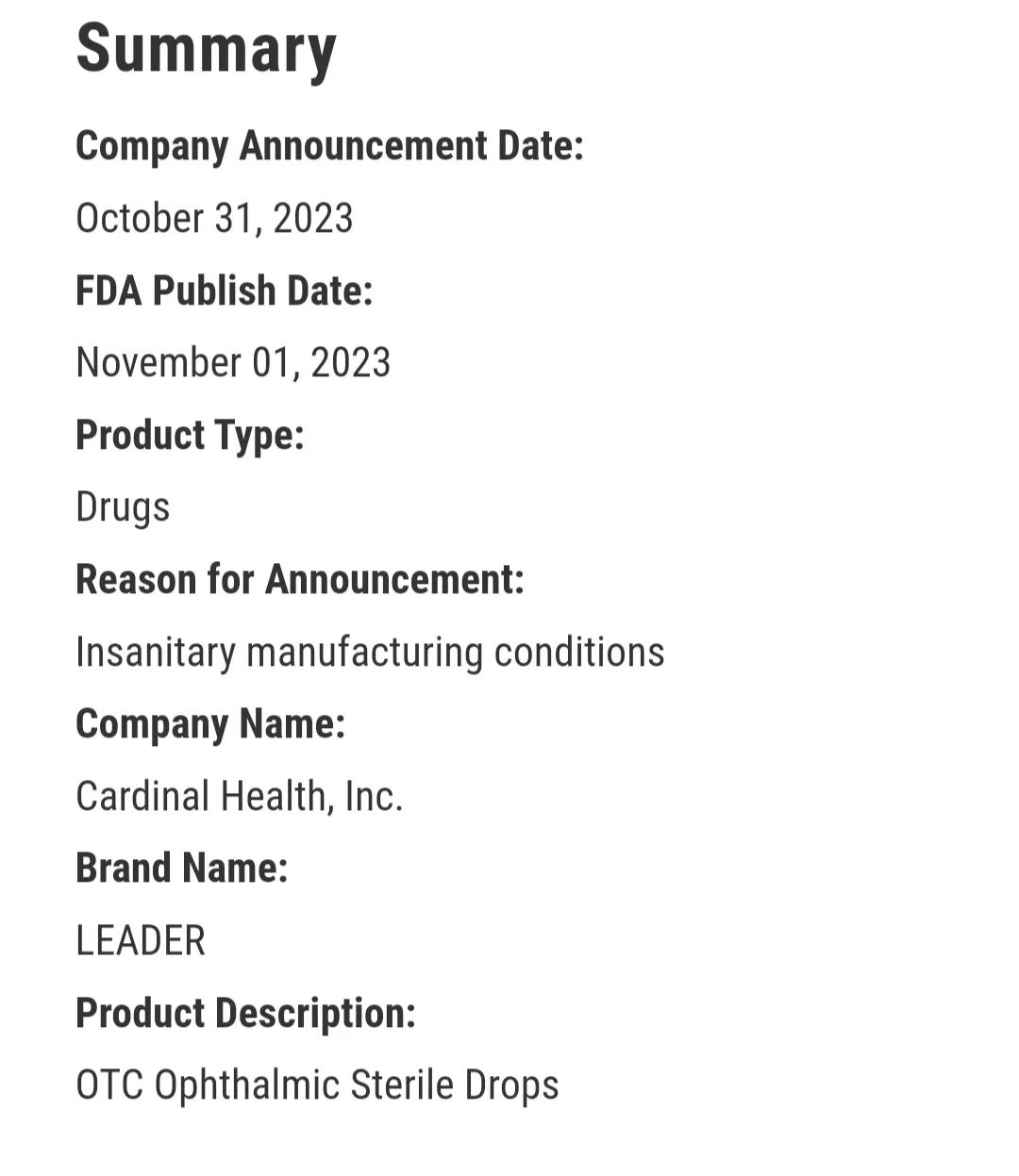
就这次召回来说,涉及六种药的所有批次。最早的药品发货时间则是2021年12月12日,从发货到发起召回已经过了将近两年。两年才发觉生产设备及环境有重大的污染风险,可谓后知后觉。

造成这种情况,可能是多方面的。
一、灌装等关键设备清洁不彻底
如果是彻底的清洁,那么附着在设备上的原辅料缺失,微生物生存滋生缺乏必要的营养组分,很难实现增殖。考虑到两年里多个批次都有清洁,那么可能存在清洁死角,也就是说每次那里都难以清洁到。清洁验证及设备设计时,没有察觉这里难以清洁,造成了后续的不断累积污染。
二、环境消毒及设备灭菌有缺陷
如果说清洁不彻底,而环境消毒和设备灭菌彻底,那就可能是另外一个状态,“多个药品组分交叉污染,但无菌性未受影响”。这在灌装验证和空调系统消毒验证里都存在问题,没能模拟到最差生产状态。我们在类似的模拟灌装时,因为已经明确所有灌装药品都会经培养,所以为了提高成功率,会不断要求,“一定要拿出最严谨的态度,来面对这个验证。”实际上,应该是在符合标准的最差条件下验证,这样才无限的趋近真实情况,验证才有意义。就像你模拟保护财产,模拟时请来了正规军,而平时只是找几个退休老大爷看大门,自然也就失去了验证的意义。
三、产品留样检没能实现评价效果
药品在售出后,会有留样检,对无菌也是有要求。考虑的就是包装形式的符合,看现有包装会不会有缓慢失效而引发污染。再就是看日常保存中有没有引发药物组分的改变,比如某个成份的降解等等,原本投料时加的足足的,避免卖出去半年成份不达标了而不自知。当然这种放库房的方式,有一定的缺陷性,因为你没有办法去模拟运输中的条件变化,搞不好到头来,真得遇到几十个批次都出问题,你会把一切责任都推给运输条件。
四、监管不到位
飞检和常规检查都是对企业的生产状态和质量体系运营做评估,这两年了,药监局就没来过?确实不可能面面俱到,但对无菌制剂来说,环境和无菌性,那是重中之重,怎么能不做到严查细查呢?

这对于其他药企而言,也是一个非常大的教训,药品卖出去两年没事,不等于一切安全。可能几个不良反应事件,就打破了你对安全性的幻想。药品质量问题的发现,存在滞后性,不是你当时一看就能看出来的。而且成品检在无菌上也是存在概率性的,不是你每次抽样都能找到有问题的那瓶药。一切都隐藏在生产环节,所谓的抓质量,其实就是抓生产环节的每个步骤。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57