10月24日,CDE官网显示,信达生物的GFH925片(IBI351)被纳入拟优先审评品种,适应症为至少接受过一种系统性治疗的KRAS G12C突变型的晚期非小细胞肺癌。

第一款国产!
信达生物将摘得?
IBI-351是一款高效口服共价、高选择性的KRAS G12C抑制剂,由劲方医药开发,信达生物于2021年9月与劲方医药宣布就IBI-351达成全球独家授权协议。
目前,IBI351已有两项适应症被CDE授予突破性治疗认定,分别为治疗至少接受过一种系统性治疗的KRASG12C突变型的晚期非小细胞肺癌患者以及至少接受过两种系统性治疗的KRASG12C突变型晚期结直肠癌患者。IBI351是国内首 个纳入突破性治疗药物、治疗晚期结直肠癌的KRAS G12C抑制剂。
在今年的AACR会议上,IBI-351的一项1期剂量递增结果公布【1】:
截至2022年12月15日,在所有剂量水平的67个可评估反应的NSCLC患者中,ORR为58.2%,确认的ORR为44.8%;疾病控制率为92.5%。在600mg BID剂量水平(RP2D)下,ORR为63.3%,确认ORR为50.0%,DCR为96.7%。
今年的ASCO会议上,IBI-351单药治疗携带KRASG12C突变的转移性结直肠癌的有效性和安全性的两项1期研究初步结果(NCT05005234,NCT05497336)公布。
研究结果显示:截至2022年12月15日,所有剂量水平的疗效可评估患者的ORR为47.5%,DCR为85.0%。未达到中位缓解持续时间(DOR)。对于32例600mg BID的疗效评估患者,ORR和DCR分别为43.8%(14/32)和87.5%。
深陷“冰火两重天”
KRAS抑制剂亟待再突破
RAS基因是第一个被鉴定的人类致癌基因,针对该靶点已有多款药物在研中,包括博瑞生物的BGC-1201,一款靶向RTK-RAS-MAPK 信号通路的抗肿瘤药物。KRAS则是RAS基因家族中最为常见的一类突变。
日前,BMS以58亿美元收购Mirati,并获得其KRAS G12C抑制剂Adagrasib,有力证明了KRAS靶点的研发地位。但与此同时,第一款获FDA批准上市的KRAS 抑制剂Sotorasib却陷入难以转正的困局:确证性研究CodeBreaK 200的主要研究终点(无进展生存期PFS)遭到FDA委员会质疑。
据了解,KRAS靶点是有名的“不可成药”靶点,其蛋白过于“光滑”,药物难以楔入该蛋白中。而KRAS G12C突变蛋白是该类药物研发的突破口。但多年来,KRAS抑制剂研发之路仍然困难重重,折戟是常态【2】。
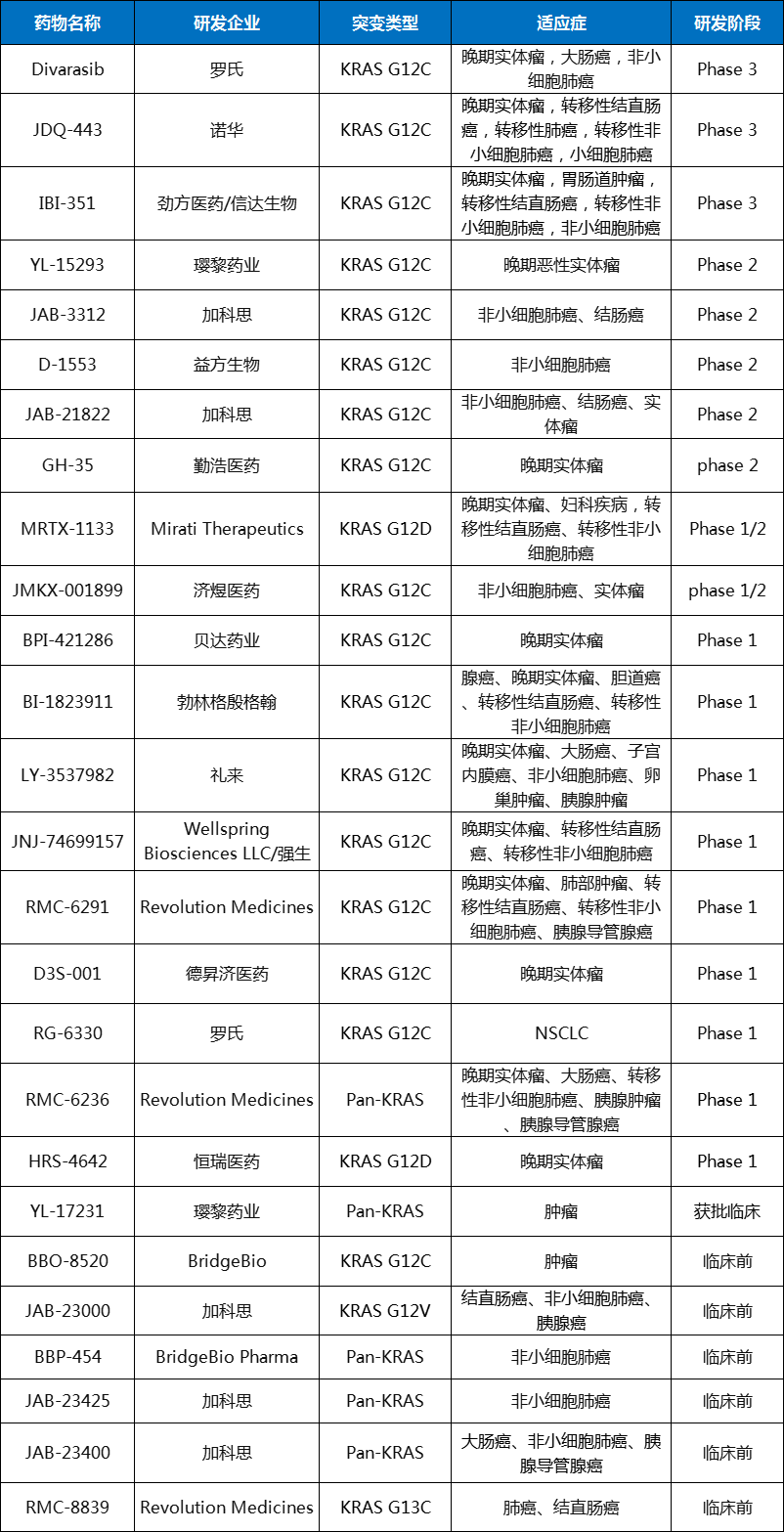
目前在全球范围内,包括安进、诺华、罗氏在内的多家药企正开发KRAS抑制剂,在研药物数十款,但上市药物仅上述两款。此外,大多数在研KRAS抑制剂仍为G12C突变体,G12D等常见突变形式以及G12V和G12S等罕见突变形式还待突破【1】。
小结
作为我国企业自主研发的KRAS抑制剂,IBI-351获得CDE优先审评,有望加速上市进程。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57