近日,和黄医药发布公告称,呋喹替尼获美国FDA批准,用于治疗既往接受过氟尿嘧啶类、奥沙利铂和伊立替康为基础的化疗、抗血管内皮 生长因子(VEGF)治疗,以及抗表皮生长因子受体(EGFR)治疗(若属RAS野生型及医学上适用)的成人转移性结直肠癌患者。
值得一提的是,呋喹替尼是美国首 个且唯一获批用于治疗经治转移性结直肠癌的针对3种VEGF(VEGFR1/2/3)受体激酶的高选择性抑制剂,且是通过优先评审通道获批。
呋喹替尼成功出海后,和黄医药还有哪些布局?
01
第一款 自研产品发力,
开辟“出海”之路
呋喹替尼是和黄医药自研的第一款 抗癌新药,于2018年9月在国内获批上市,用于治疗转移性结直肠癌(mCRC)患者,而当下呋喹替尼出海成功,使其成为首 个中国原创出海的实体瘤小分子TKI。
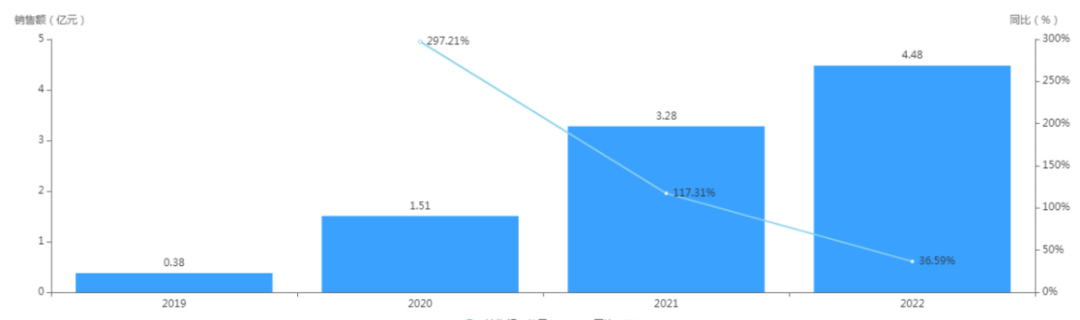
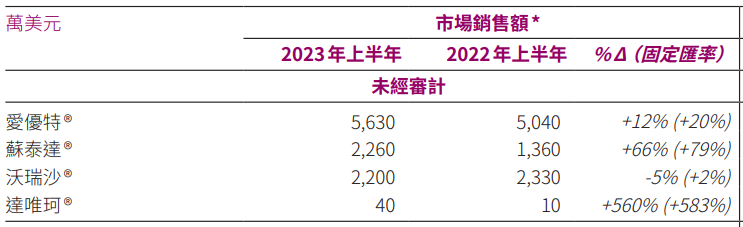
据药智数据查询显示,呋喹替尼在纳入2019版《国家医保目录》后的首年,国内公立医疗机构销售额大涨,增速达297.21%,且销售额保持逐年增长,2022年达4.48亿元人民币;据和黄医药2023半年报显示,上半年销售额为5630万美元,同比增长12%,在国内市场份额维持领先优势。
“出海”是国产创新药得到全球认可的必经之路,而呋喹替尼的国际市场前景也得到跨国药企青睐。2023年1月,武田制药与和黄医药达成独家协议,获得呋喹替尼中国内地、中国香港和中国澳门以外全球开发、商业化和生产权利,交易金额最高达11.3亿美元,包含4亿美元首付款,及里程碑付款,且外加基于净销售额的特许权使用费。
优异的疗效撕开了美国市场的口子,据国际多中心临床3期试验FRESCO-2研究数据显示,691名患者(治疗组461名,安慰剂组230名)中,治疗组中位OS为7.4个月,安慰剂组为4.8个月;治疗组中位PFS为3.7个月,安慰剂组为1.8个月;治疗组的疾病控制率(DCR)为56%,而安慰剂组为16%。
值得一提的是,FRESCO-2研究是在美国、欧洲、日本及澳洲开展,2023年6月,呋喹替尼用于治疗经治转移性结直肠癌成人患者的上市申请获欧洲EMA受理,2023年9月,同样适应症的上市申请又向日本PMDA提交。
美国外的市场更大,据国际癌症研究机构IARC数据显示,结直肠癌是全球第三大常见癌症,2020年约造成超93.5万例死亡,美国2023年预计新增15.3万例,死亡5.3万例,而欧洲在2020年就新增约52万例,死亡约24.5万例,日本在2020年则新增约14.8万例,死亡6万例。
此次在美获批,加之欧洲和日本更大的市场迫切需求,将促使呋喹替尼在欧洲和日本的快速获批。
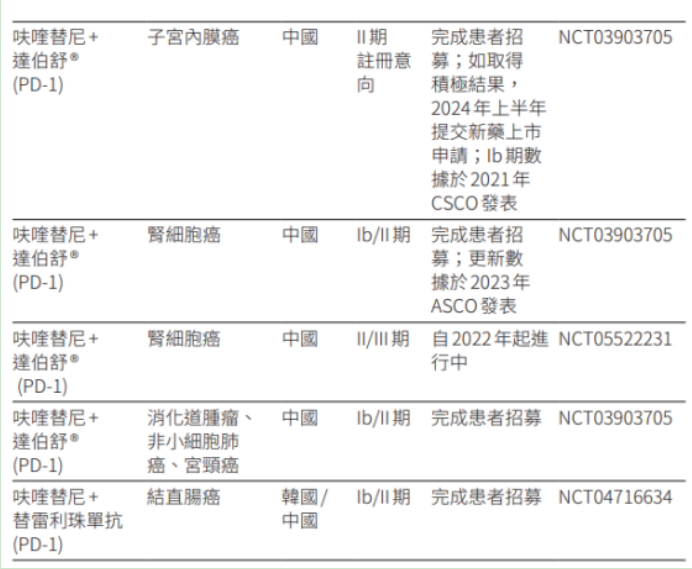
此外,呋喹替尼联合紫杉醇用于二线治疗晚期胃癌和胃食管结合部腺癌的上市申请,在2023年4月获国家药监局受理,另据和黄医药2023半年报显示,呋喹替尼还有多个适应症临床试验在推进,其中,呋喹替尼联合达伯舒(信迪利单抗)治疗晚期子宫内膜癌在2023年7月被纳入突破性治疗品种。
随着呋喹替尼国外市场的继续拓展,以及新适应症的即将获批,将为其带来市场的持续放量增长。
02
肿瘤领域的“急先锋”,
已逐渐挑起大梁
自抗癌新药呋喹替尼获批上市以来,和黄医药的业绩就上了新台阶,2020年走出之前连续两年营收负增长的阴影,实现了11.27%的营收增幅,2021年和2022年,营收连续两年创新高,2022年度营收已接近30亿元人民币。
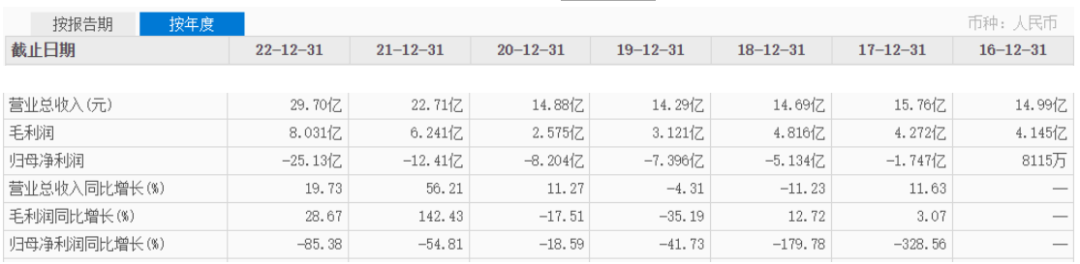
虽然归母净利润持续为负值,但主要是和黄医药在肿瘤/免疫业务上,为建立潜在全球同类始创或同类最 佳候选药物,长期投入大量资源有关:2020年至2022年,肿瘤/免疫业务产生的公司应占净亏损分別为1.76亿美元、2.92亿美元及3.85亿美元,按同期汇率计算,已超过上图对应年度的归母净利润亏损额。
从研发投入上可以看出,和黄医药倾其所有,对肿瘤/免疫业务的巨大付出。
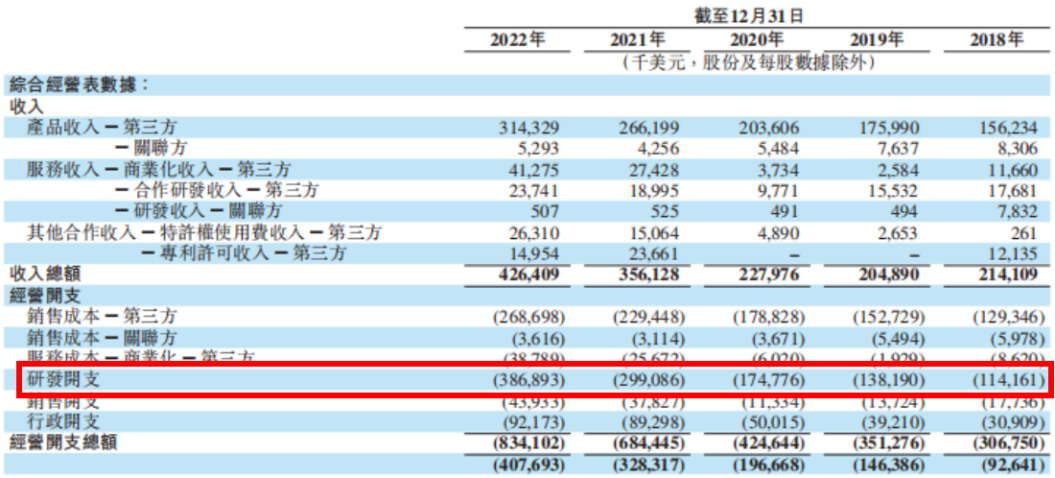
据和黄医药2022年报显示,其它业务2020年至2022年产生的应占净收益分别为7280万美元、1.43亿美元和5460万美元,均被用于肿瘤/免疫业务,甚至在2021年出售白云山和黃资产,以专注于肿瘤/免疫新型疗法。2018年至2022年,和黄医药研发开支持续增长,2022年达到3.87亿美元,截至2022年已为肿瘤/免疫业务投入超过15.90亿美元。
付出终归有回报,和黄医药已获批上市的4款药物中,呋喹替尼、索凡替尼和赛沃替尼均为自主研发,且均通过优先审批通道获批,是国产新药中有名的“替尼三将”。另一款产品他泽司他的来头也不小,是由Ipsen授权和黄医药在中国研究、开发、生产及商业化的同类始创EZH2口服拟制剂,目前已作为临床急需进口药,在海南先行区获批上市,以及在澳门也获批上市,且香港的上市申请正在评审中。

产品市场动力十足,据和黄医药2023半年报显示,4款产品上半年的销售额,除赛沃替尼(沃瑞达)出现5%的同比下滑外,其它产品均实现同比增长,其中,索凡替尼(苏泰达)和他泽司他(达唯珂)同比增长达66%和560%。
和黄医药也正在加快和赛沃替尼“出海”进程,据2023半年报显示,索凡替尼除在中国开展的系列临床试验外,还在日本开展了神经内分泌瘤的单药疗法桥接研究,此外,索凡替尼的多项研究,在2023年美国临床肿瘤学会(ASCO)和美国癌症研究协会(AACR)年会上发布,其中,与特瑞普利单抗等联合疗法最引人关注。
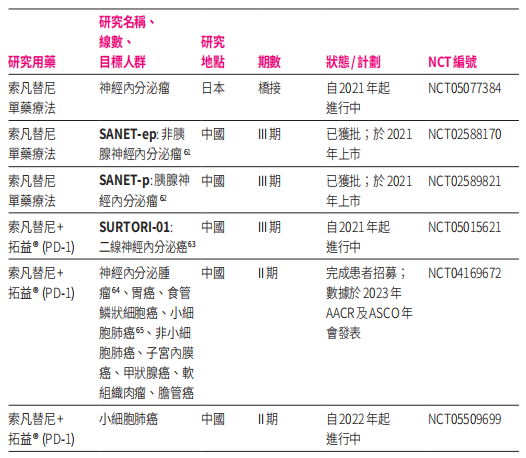
据索凡替尼和特瑞普利单抗联合用于多种晚期实体瘤的单臂2期研究数据显示,在疗效可评估的放射 性碘难治性的分化型甲状腺癌患者中,中位PFS为10.9个月,中位OS尚未达到(中位随访时间为22.1个月);在疗效可评估的子宫内膜癌患者中,中位PFS为5.4个月,12个月OS率为71.0%,且均显示出可耐受的安全性特征。
尽管之前闯关美国和欧洲市场,因需进行国际多中心临床试验而暂缓,但国际多中心临床试验要的只是时间和资金的投入,从和黄医药在肿瘤业务的大力布局来看,笔者预计索凡替尼的国际多中心试验将于未来不久开展。
赛沃替尼的进展也已取得实质性进展,2023年1月,赛沃替尼与奥西替尼的联合疗法已获美国FDA授予快速通道资格,这是基于联合疗法的全球关键性2期SAVANNAH研究。
据SAVANNAH研究显示,294名治疗既往接受奥西替尼治疗后疾病进展的表皮生长因子受体(EGFR)突变、间充质上皮转化因子(MET)驱动的非小细胞肺癌患者,随着MET异常水平升高,疾病缓解率有提高趋势,客观缓解率(ORR)为32%,中位缓解持续时间(DOR)为8.3个月,中位无进展生存期(PFS)为5.3个月;符合高MET异常水平阈值的108名患者,ORR为49%,中位DOR为9.3个月,中位PFS为7.1个月。
此外,赛沃替尼还在开展肾癌的全球性临床试验,目前已进展至3期阶段,而与奥西替尼的联合疗法在2022年就已推进至全球性临床3期。
“替尼三将”作为和黄医药进军肿瘤领域的“急先锋”,已逐渐挑起大梁,而和黄医药的产品“大部队”还在后面。
03
候选管线丰富,
免疫领域雏形已现
据和黄医药2022年报显示,和黄医药在全球肿瘤患者中进行约40项不同临床研究,其中有超过15项3期临床注册及2期注册意向研究。
HMPL-689是一种高选择性小分子抑制剂,治疗滤泡性淋巴瘤已被纳入突破性治疗品种,且已处于2期临床阶段;治疗惰性非霍奇金/外周T细胞淋巴瘤已进展至1b期阶段,研究结果在2023年欧洲血液协会(EHA)和国际恶性淋巴瘤会议(ICML)上发布。
据研究显示,滤泡性淋巴瘤队列的数据进一步成熟,中位随访时间为22.1个月,滤泡性淋巴瘤队列中26名疗效可评估患者的中位缓解持续时间(DOR)和无进展生存期(PFS)尚未达到;边缘区淋巴瘤队列中16名疗效可评估患者中位DOR尚未达到,中位PFS为26.8个月。
HMPL-523是一种高选择性Syk口服抑制剂,也被纳入突破性治疗品种,用于成人原发性血小板减少症(ITP)的ESLIM-01中国关键性3期研究结果在2023年8月公布,显示已达到持续应答率的主要终点及所有次要终点,预计在2023年底左右提交上市申请。
值得一提的是,和黄医药在之前的年报中提到,视中国3期研究的结果,決定是否在美国启动1期免疫性血小板减少症临床试验,目前,中国3期临床结果积极,和黄医药又多了一款有“出海”潜力的候选药物。
除了上述获批产品和候选药物,和黄医药在肿瘤领域还有多款已进入临床阶段的管线产品,分别为HMPL-453、HMPL-306、HMPL-760、HMPL-295、HMPL-653、HMPL-A83和HMPL-415,其中,HMPL-453临床最高阶段为2期,其余均为1期。
04
小结
多年来,和黄医药一心一意做好肿瘤新药的开发,其免疫领域虽处于创业初期,但随着肿瘤业务步入轨道后,凭着之前做肿瘤新药的“用情专一”,免疫领域何愁不能再出一个“替尼三将”组合先锋。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57