近日,NMPA官宣成为药品检查合作计划(PIC/S)正式申请者,我国药品制造的国际化脚步又迈出了坚实的一步。
一直以来,国内药企想要实现药品出口就难免要重新设计改造GMP厂房车间,同时还要承担高额的资质维护费,以及所在国派遣检察员的现场检查费用,费时费钱费力。
随着PIC/S确认国家药监局的正式申请者身份,无疑将助力解决上述问题,实现药品国际化的“最后一公里”。
01
加入PIC/S,
国家局早已筹划
PIC/S(Pharmaceutical Inspection Cooperation Scheme),即药品检查合作计划。
该组织的前身是1970年欧洲自由贸易联盟(EFTA)成立的PIC,目的是为了消除国与国之间的贸易壁垒,实现GMP互认。
当前,已有>50个国家和地区的药监机构成为PIC/S成员,如FDA、PMDA、TGA、MHRA等;同时,WHO、EMA等均为PIC/S的合作组织。
加入PIC/S,分两步:1)预加入申请,最长期限2年,该阶段PIC/S会对申请机构的药品检查体系进行评估。2)正式申请,最快1.5年,最慢6年,该阶段PIC/S需要进行系统、全面的评估工作。评估过程中,审计清单设定11个模块对整个检查体系进行评估,范围涵盖法规、GMP标准、检查程序等。模块项下,再细分亚指标,以及对应的重要程度、评估方式等。
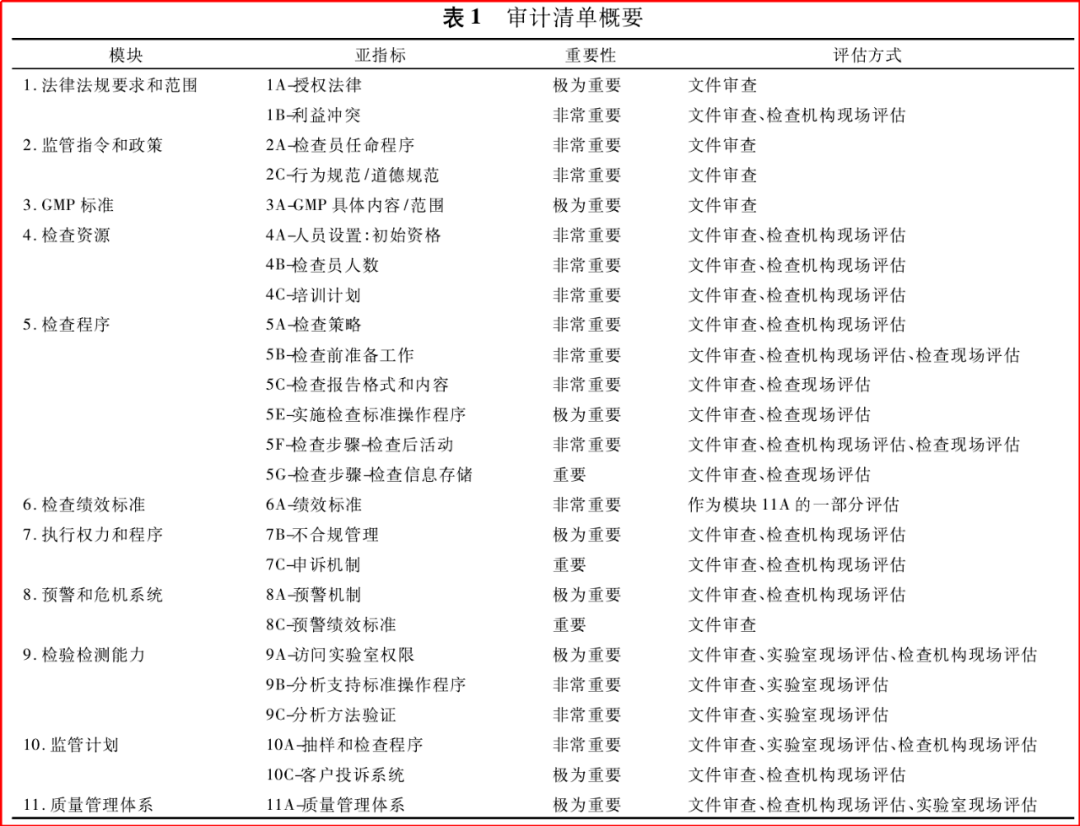
由上述加入PIC/S程序可知,NMPA本次“正式申请”,是在已经取得了部分成绩的基础上,而更进一步的工作,时间上至少应该是在1-2年以前。但,实际上对于加入PIC/S这件事,从国家药监局网站搜索可知,早在十余年前,就已经考虑这件事了。
如,早在2008年,国家局曾邀请美国FDA、欧盟EMEA、WHO、PIC/S以及相关协会等,就实施药品GMP的先进经验、药品GMP发展趋势及相关的法律法规等进行交流与研讨;2012年,药品安全监管司发布《境外药品生产企业检查管理办法》征求意见,其中现场主文件内容的具体要求按照PIC/S关于现场主文件的最新要求撰写。
2021年,国家药监局正式致函PIC/S,申请启动预加入程序,相关工作开始紧锣密鼓布置起来,同年国家药监局以预申请成员身份参加PIC/S委员会会议,介绍中国实施GMP检查的现状,表达了成为PIC/S成员并与各方开展实质合作的意愿。2022年,国家药监局召开加入PIC/S工作领导小组办公室会议,研究当前重点工作任务及下一步工作安排。
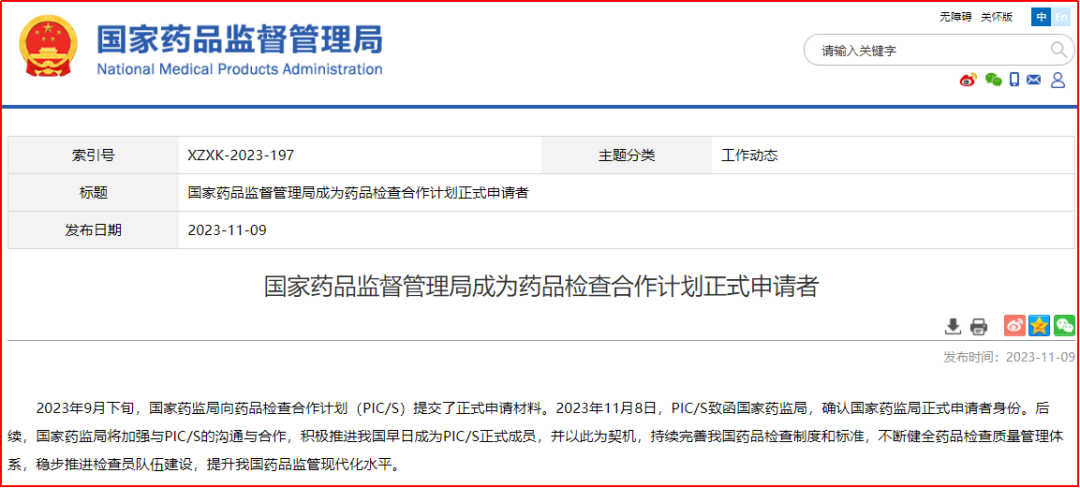
2023年,国家药监局召开加入PIC/S工作推进会;9月向PIC/S提交了正式申请材料;11月,PIC/S致函国家药监局,确认国家药监局正式申请者身份。
02
加入PIC/S,
有什么好处?
总的来说,加入PIC/S首先会完善我国药品监管检查体系以及相应的质量管理体系,从而形成自上而下的高质量、国际化要求,同时细化相关GMP检查工作内容,同世界接轨,形成互认。
PIC/S官网提到的优势主要包括“培训机会、国际GMP协调、关系建立、标准提升、信息共享、快速警戒系统以及促进其他协议的签订”,这里笔者结合实际,重点介绍下加入PIC/S在GMP国际化以及检查标准统一互认两个角度进行细述。
GMP实施/检查-国际化
GMP标准是PIC/S成员机构间互认的基础,PIC/S GMP在经历数十次修订后,目前官网公开的版本为PE009-17,包含20个GMP附录,以对具体的药品生产进行详尽的工作指导。同时,持续关注先进的生物技术、放射 性药物、人工智能等领域的发展,引领全球药品制造新技术/新方法相关指南的起草和制定,以保证药品监管更好的服务促进技术的发展。
加入PIC/S,无疑将使我国GMP与PIC/S-GMP形成更好的衔接。说到这,其实这一点,在今年1月由核查中心发布的药品GMP指南(第2版)就可以发现,很多内容进行了更加合理的整合,并增加了多个章节。
检查工作标准统一,实现互认
由于我国幅员辽阔,各省级药监部门在检查工作的许多方面存在差异,与PIC/S要求也存在差距。
如,检查计划,虽然按照相关监督检查管理办法,明确要求按照基于风险制定检查计划,但可操作性不强,执行过程中非客观因素较多,尺度不统一,加入PIC/S无疑可提升在计划制定过程中的科学性。
再如,检查实施,PIC/S对检察员配备了较完善的检查备忘录,以及缺陷项分类指南,同时还对检查报告要求格式统一,加入PIC/S将有利于我国检查报告结果在各成员机构之间的检查互认。
03
面对PIC/S,
国内药企需要准备什么?
正如当年加入ICH一样,当NMPA加入PIC/S后,药企要做哪些准备工作,或者说要提前注意哪些事项,这是从业者更为关心的问题。
首先,新版GMP的理解实施,肯定是国内药企GMP体系软硬件加强的重点方向。“药品GMP指南”第2版,是以上一版内容为基础,并结合过去十几年国内外制药行业的具体实践,吸收ICH、WHO、PIC/S、美国FDA、EMA有关指南,从而形成的基于风险的科学监管。
第2版指南发布后,大约在今年上半年,曾一度形成阶段性的解读学习,尤其是对一些新增内容的深入解读,国内药品制造行业对此已初步的有所了解。
由此,再联系今天的PIC/S申请,足见新版GMP内容的倾向性,以及落实的必要性。

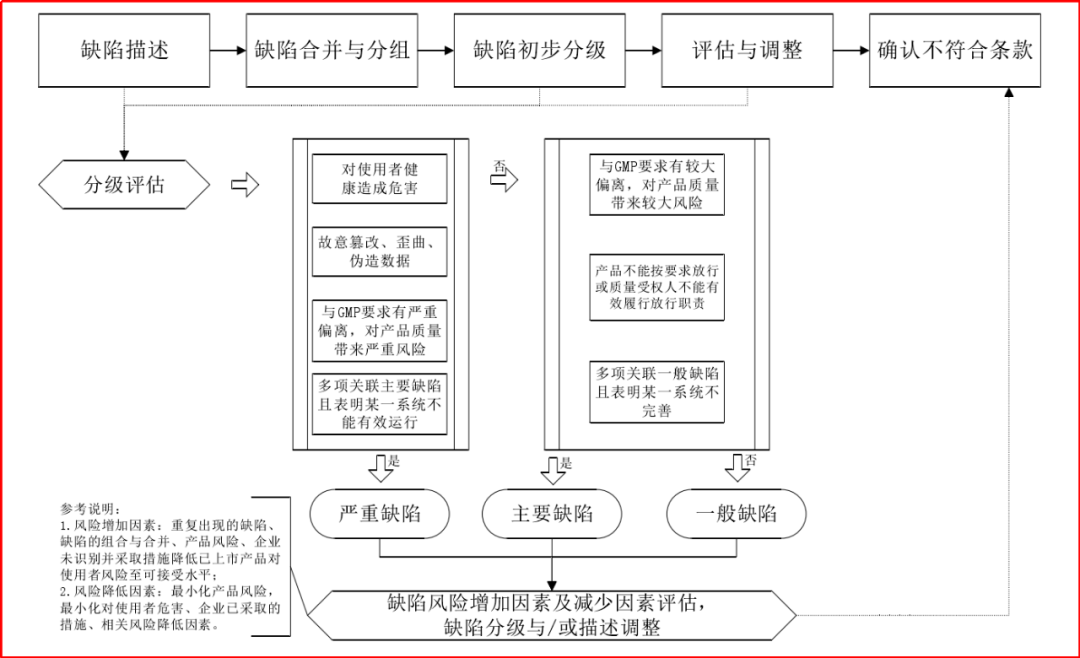
其次,检查工作中缺陷的评估定性,无疑是药企关注的重点讨论内容。PIC/S已经发布相关的缺陷分级指南《PIC/S GUIDANCE ON CLASSIFICATION OF GMP DEFICIENCIES》,该指南概述了缺陷分级的定义、要求和检查实践,并形成了药品GMP检查缺陷分级决策流程。
缺陷分级可包括“严重缺陷、主要缺陷、一般缺陷”,且在缺陷初步分级后,需要结合缺陷风险增加因素和缺陷风险减少因素开展进一步的评估。具体的缺陷评估流程可详见下图。
再,就是认识层面的主客观统一。虽然加入PIC/S已成功在即,但要清楚的是加入PIC/S也并不意味着之后就可以直接和其他国家进行GMP互认,不过该工作肯定会为更为深入的互认打下基础。
在原料药、仿制药获得国际认可后,我国的创新药已相继出海成功,开放的同时也伴随着竞争的加剧以及国际化。
而药品制造体系想要在此过程中获得更好的利润空间,PIC/S的加入以及更加良好的GMP体系的管理实施,无疑会形成助力,为竞争带来更好的筹码。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57