过去40多年,由于研发难度大导致药物稀缺,庞大的NASH患者面临无药可治的困境。
据弗若斯特沙利文报告,2020年全球和中国的NASH患者人数分别高达3.5亿人、3870万人,预计2030年将达到4.9亿人、5550万人,临床需求存在巨大尚未满足缺口。
不过,一旦Madrigal研发的Resmetirom获FDA批准上市后,NASH治疗药物空白的历史就将会被改写。
NASH新药研发为何难度大?除了Resmetirom以外,全球还有哪些NASH新药已临近商业化阶段?国内药企又打响了一场怎样的竞速赛?
01
NASH新药研发,
为何频频遭遇“滑铁卢”?
非酒精性脂肪性肝炎(NASH)的可怕,就在于病情恶化普遍快、风险高,还会逐渐引起肝纤维化,最终发展为肝硬化甚至肝细胞癌。
可另一边,NASH新药研发却频频遭遇“滑铁卢”。自1980年发现NASH以来,已有上百款药物研发失败,是医药领域响当当的“硬骨头”。
归其原因,主要是由于NASH新药研发存在许多难点。致病机理复杂,便是其中之一。
NASH是一种发病机制复杂的慢性代谢疾病,而这样的慢性病一般需要系统给药,疗效与安全性的平衡很难把握。根据“多重平行打击”理论,NASH是由多种风险因素、多种细胞类型和多种组织器官平行相互作用的结果,靶向其中一个通路或靶点或许不足以产生疗效。
缺乏可靠的、无创的临床终点,是NASH新药研发的另一大难点。
不同于针对其他疾病的创新药,NASH新药临床批准要求的两个替代终点(肝纤维化改善和NASH缓解)颇为严格,III期临床试验的替代终点必须采用肝穿刺活组织进行病理学评价,而不再是以影像学评价、血清学评价作为评判标准,获批门槛相当高。
另外,动物模型不能完全模拟人类NASH病例特征,也是NASH新药研发的主要难点。
由于实验动物的个体差异较大,很难找到同时模拟人类NASH病理特征、发病机制和并发症的完 美模型,因此在临床开发中NASH新药频频受挫。
例如,FXR激动剂奥贝胆酸,曾有望成为NASH领域首批新药,但因为相对安慰剂疗效不够显著且副作用明显,患者会产生较为严重的瘙痒、低密度脂蛋白胆固醇(LDL-C)升高和心血管风险等安全性问题,上市进程放缓。
此外,还有不少药物在NASH研究中遭遇挫折,包括ACC抑制剂firsocostat、Gal-3抑制剂belapectin、caspase抑制剂emricasan和SSAO/VApor-1抑制剂BI1467335等针对不同机制的靶向药物,受挫的原因或是TG升高、或是无效、或是界面肝炎等。
02
千亿赛道将迎首 款NASH新药,
GLP-1开辟“第三战场”
尽管NASH领域是研发黑洞,但巨大的市场空间仍吸引着不少海外药企冒险一试。
根据弗若斯特沙利文数据,随着创新药物逐步商业化,预计2025年全球和中国的NASH市场规模将分别达到107亿美元、32亿元,并于2030年达到322亿美元、355亿元,妥妥的千亿级大赛道。
从研发情况看,基于“二次打击”学说和“多重平行打击”理论,药企主要针对代谢异常、炎症和纤维化3个方向开发NASH药物,从而衍生出许多针对不同机制的靶向药物。据统计,目前全球已有上百种NASH药物在研,靶向近20种靶点,其中较热门的靶点有PPAR、THR-β、FXR、GLP-1和FGF21等。
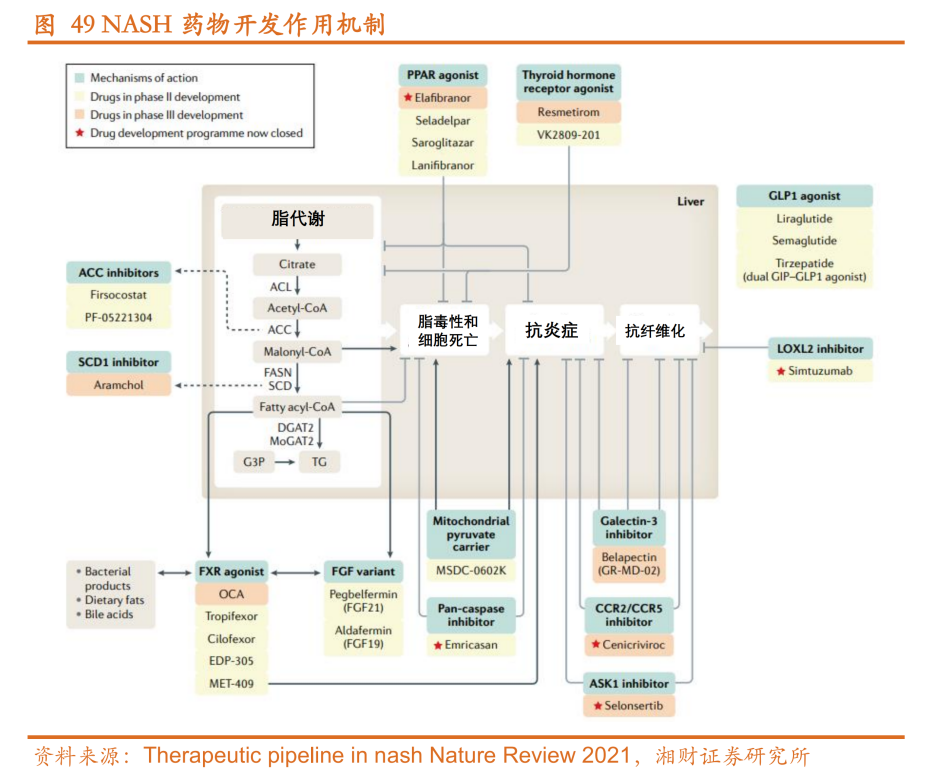
就海外市场而言,最有望成为NASH领域首批新药的是Madrigal研发的Resmetirom。
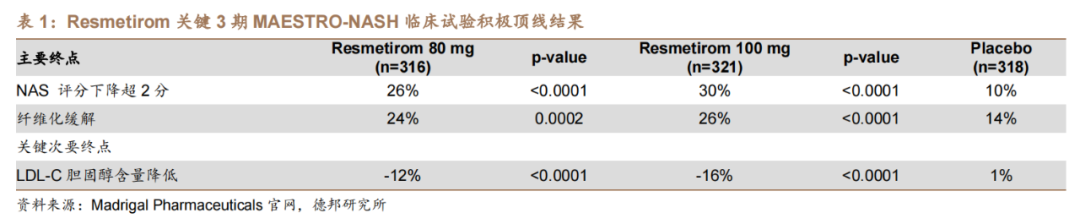
Resmetirom(THRb T3肝导向甲状腺荷尔蒙靶向药)属于THR-β激动剂,通过靶向甲状腺激素通路降低肝脏脂肪,2023年4月凭借优异的疗效和安全性数据,获得FDA突破性疗法认证,并于7月向FDA递交了NDA。
2022年12月,Madrigal宣布Resmetirom用于治疗NASH的关键性III期MAESTRO-NASH研究达到双重主要终点。在NASH缓解且纤维化不恶化的主要终点上,高剂量组、低剂量组和安慰剂组的发生率分别为30%、26%、10%。关键次要临床终点:LDL-C胆固醇含量:80mg组降低12%,100mg组降低16%,安慰剂组提升1%,P<0.0001。
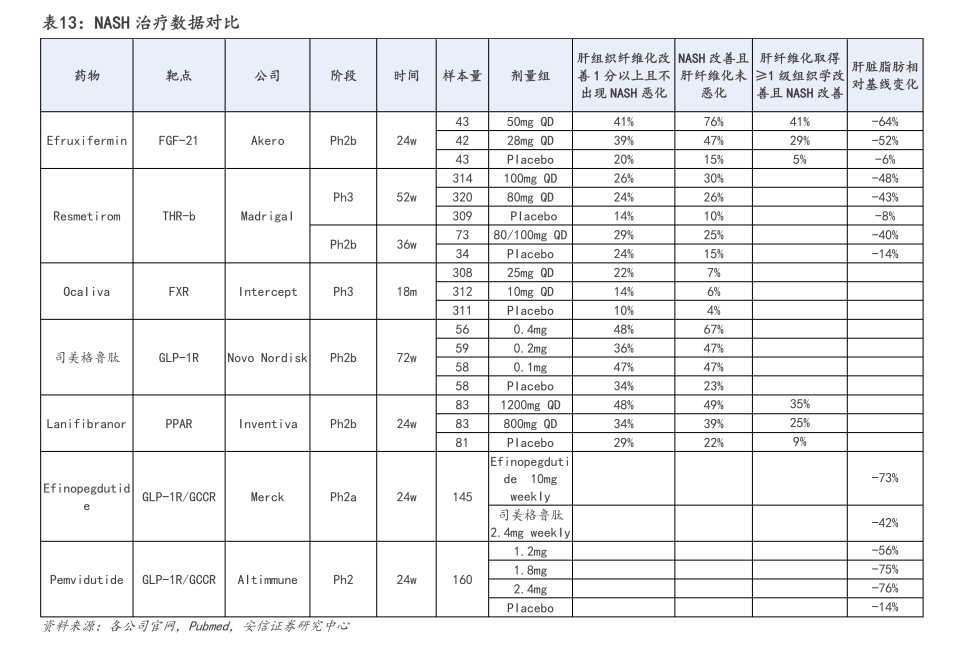
另外,Akero开发的FGF21类似物Efruxifermin,也展现出了积极的疗效。
根据Efruxifermin治疗肝硬化前NASH IIb期HARMONY研究的数据显示:28mg剂量组、50mg剂量组(均为每周一次皮下注射),在第24周时,纤维化改善≥1级且NASH没有恶化的患者分别为39%、41%,是安慰剂组(20%)的2倍,不仅达到主要临床终点,还刷新了NASH新药有效性数据。
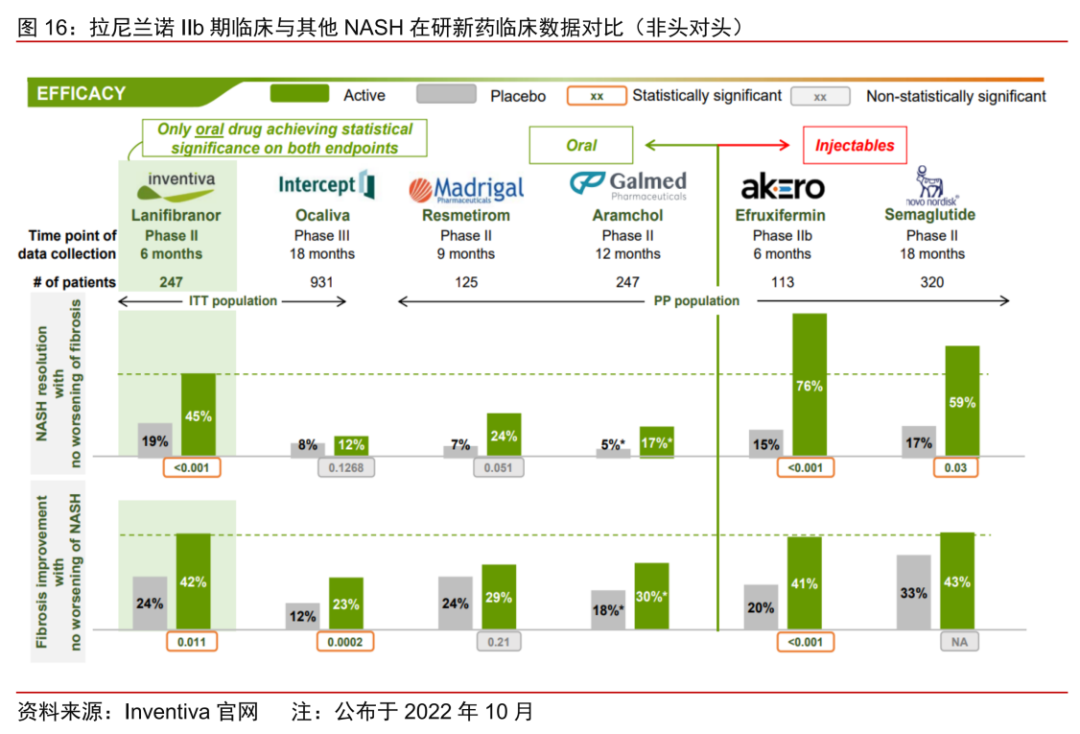
除此以外,海外市场还有不少NASH新药已临近商业化阶段。其中,靶向PPAR的由Inventiva和中国生物制药合作的拉尼兰诺(lanifibranor)和Zydus-Cadila Group研发的Saroglitazar,以及靶向FXR由Intercept研发的FXR抑制剂Obeticholic acid,均已处于Ⅲ期临床。如若顺利获批,未来几年NASH新药将迎来密集上市期。
值得一提的是,针对NASH的药物类型,还出现了GLP-1类药物的身影,这也是继糖尿病、减肥药后开拓的第三个重磅应用领域。根据安信证券研报测算,国内GLP-1 NASH市场规模将达到70亿元-140亿元之间。
在这方面,研发进度最快的是诺和诺德的司美格鲁肽(Semaglutide),也是目前唯一一款在NASH适应症上进展至Ⅲ期临床的GLP-1类药物。
根据II期临床结果显示,2.4mg剂量每周注射一次司美格鲁肽,虽然不能在不恶化NASH的情况下改善纤维化,但是可以改善心脏代谢参数和肝损伤的非侵入性标志物,治疗48周后,司美格鲁肽组中23名(49%)患者的脂肪变性减少了30%或更多,显著高于安慰剂组(13%)。
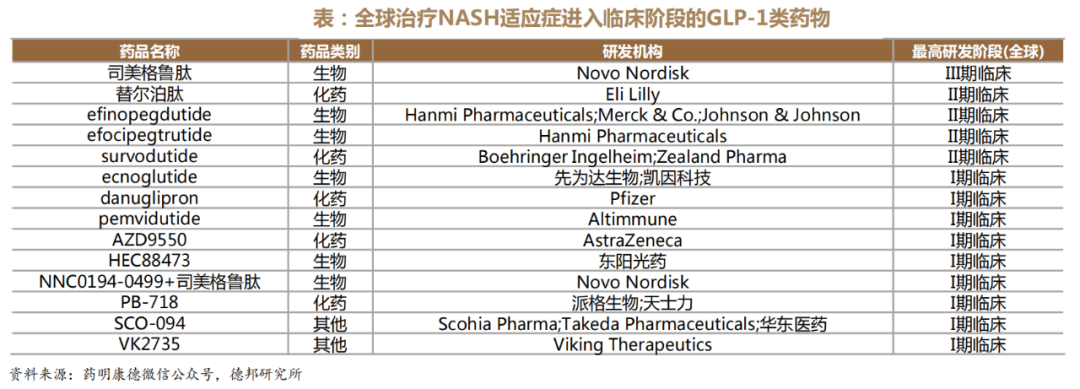
默沙东与Hanmi合作研发的GLP-1R/GCGR双靶点激动剂Efinopegdutide正在开展治疗非酒精性脂肪性肝病(NAFLD)的2a期临床试验,并以积极疗效获得了FDA授予的快速通道资格。
根据研究结果显示,与阳性对照组司美格鲁肽组相比,Efinopegdutide治疗24周后相对基线状态可显著降低患者肝脏脂肪水平(Efinopegdutide:-72.7%vs司美格鲁肽:-42.3%)。
03
国内NASH新药研发竞速赛:
中生制药、歌礼、众生…
如此巨大的蓝海市场,自然少不了国产药企的介入。
据不完全统计,国内已有超20款NASH药物在研,不过大多仍处于临床早期阶段,并集中在THR-β、PPAR和FXR等热门靶点,涉及中国生物制药、歌礼制药、海思科、微芯生物和众生药业等。
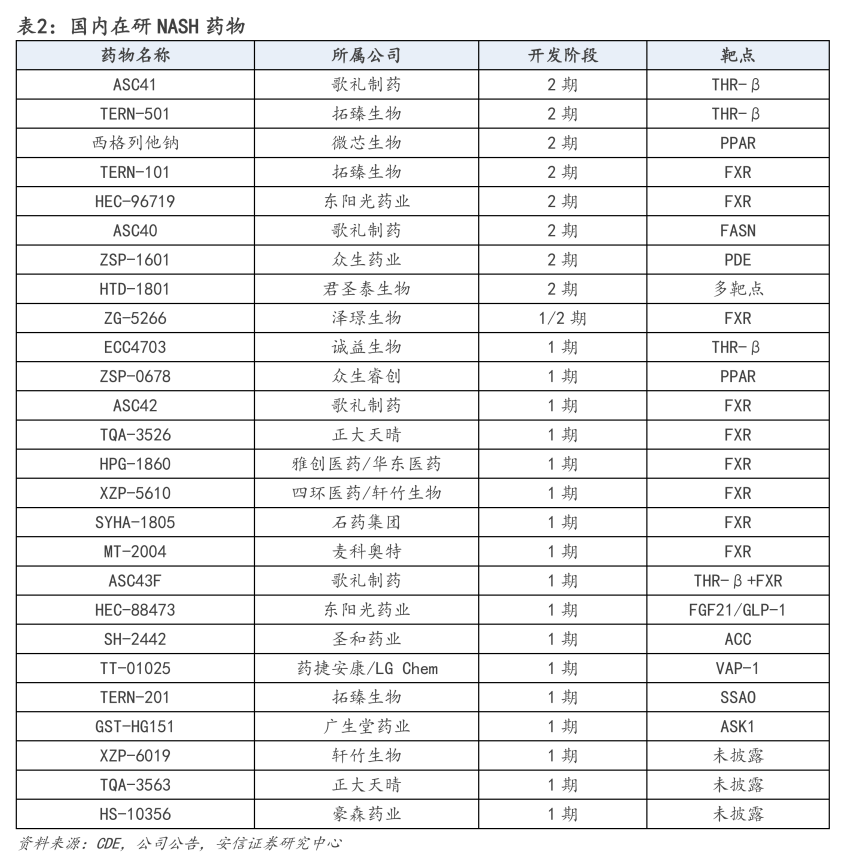
就研发进度而言,中国生物制药附属公司正大天晴于2022年9月向Inventiva引进大中华区的拉尼兰诺(lanifibranor),是中国 第一个进入临床Ⅲ期的NASH口服药物,也是FDA在全球范围内批准的第一个Ⅲ期口服PPAR激动剂、第一个同时满足FDA和EMA的NASH新药申请标准的口服小分子候选药物。
相较于其他仅靶向一种或两种PPAR亚型的PPAR激动剂,拉尼兰诺能够靶向所有三种PPAR亚型,而且适中且平衡的泛PPAR结合特性可以使药物有良好的耐受性。
根据Inventiva在2022年10月公布的对比数据,在口服NASH新药中,拉尼兰诺的II期数据明显优于奥贝胆酸、Resmetirom和此前公布的SCD1抑制剂Aramchol数据,临床效果仅次于注射剂品种Efruxifermin最新公布的数据,具备Best-in-Class潜力。
在国内,2023年7月,正大天晴就Lanifibranor片(拉尼兰诺)向国家药监局CDE递交申请并获同意拟纳入突破性治疗药物程序,国际多中心III期临床试验即将在中国启动入组,有望成为国内First-in-Class新药。
歌礼制药也在抢滩布局NASH领域,目前已拥有3款口服小分子在研产品:ASC40、ASC41和针对THR-β和FXR双靶点的固定剂量复方制剂ASC43F,前两款已处于Ⅱ期临床,后者已完成美国I期临床试验。
其中,ASC40(denifanstat)是一种同类始创的FASN抑制剂,在治疗经肝活检确诊中重度NASH患者的Ⅱb期临床试验取得了积极中期数据,在第26周时,接受治疗的患者中67%实现肝脏脂肪含量减少≥30%,而安慰剂(p<0.001)是18%(经MRI-PDFF评定);
THR-β抑制剂ASC41,临床进度位于中国 第一、世界第三。根据披露的Ib期临床数据显示,在20名超重和肥胖受试者(此类人群具有NAFLD特征)中,每日口服一次10mg ASC41可将LDL-C水平改善37.30%-38.85%,较同靶点的Resmetirom效果更为显著。
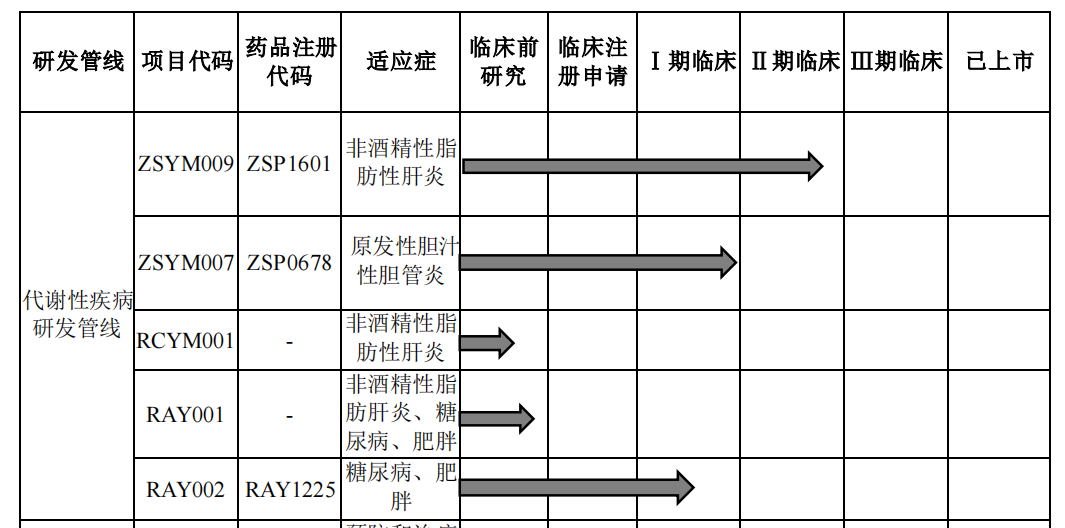
众生药业同样在代谢性疾病领域布局了3款NASH药物,包括ZSYM009(ZSP1601)、RCYM001和RAY001。其中,ZSYM009已完成Ib/IIa期临床研究,达到主要研究终点:明显地降低了ALT、AST等肝脏炎症损伤标志物,同时多个纤维化相关生物标志物也有降低趋势,提示其具有改善肝脏炎症、坏死的潜力及抗纤维化的作用。
除此以外,微芯生物的西格列他钠正在开展单药治疗NASH的II期临床,目前已入组89例患者,预计在2023年Q3内完成入组目标;四环医药/轩竹生物、雅创医药/华东医药和石药集团,均有针对NASH适应症的在研FXR抑制剂处于临床Ⅰ期阶段。
04
结语
古语云:“民望之,若大旱之望云霓也”。目前NASH新药相当稀缺,市场还存在较大尚未满足的临床需求,就像大旱望云霓一样迫切。
不过,从现阶段全球药企的研发进度看,未来几年或将有多款NASH新药陆续获批上市,市场空白有望被填补。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57