“上帝关上一扇门的同时,必定会为你打开一扇窗”
曾经因新冠疫苗火遍全球,2022年一度扭亏且大赚19亿的康希诺,在2023年上半年营收0.26亿元,同比下降95.89%,净利润-8.41亿元,同比下降6975.30%。
乍一看,如此不堪的业绩,让康希诺显得很“沮丧”,其实随着新冠疫情结束后的生活回归,那些曾聚焦在疫情市场下的“明星”企业,基本都有“惆怅”,核酸检测无人问津,新冠新药“败”给了感冒药,新冠疫苗企业当然也不例外,一切似乎回到了原点。
细细回顾康希诺的抗疫历程,会发现:结束的疫情悄然“关上”了康希诺业绩持续爆发的“大门”,一缕“暖阳”从“窗户”照耀进来。
01
至死不渝的“邂逅” 留下闪耀“结晶”
康希诺对新冠病毒的热衷,超过大部分疫苗药企,在新冠疫苗Ad5-nCoV获批后,又研发吸入型Ad5-nCoV,且积极切入mRNA技术路线,不遗余力的新冠病毒疫苗的研发路上拼命前行。
除了“爆炸”般的业绩及每股最高接近800元的股价,康希诺“邂逅”新冠疫苗的“结晶”产物远不止此。
埃博拉疫苗Ad5-EBOV
首登实操“舞台”获威名。早在2017年10月,康希诺的埃博拉疫苗Ad5-EBOV就在国内获批,且作为国家储备及应急使用。2014年的西非埃博拉病毒事件,是历史以来最严重的一次,首次蔓延至大城市,在国际上引起恐慌。
值得一提的是,Ad5-EBOV是我国首 款获批的埃博拉疫苗,临床数据显示,Ad5-EBOV与默沙东的埃博拉疫苗VSV-EBOV拥有类似的保护性,但严重不良事件发生率更低,且存储温度条件优越于VSV-EBOV及多数疫苗,这让国家在应对埃博拉病毒上更有底气,但因埃博拉疫情的特殊性,Ad5-EBOV并未实现商业化生产,康希诺虽靠此较早成名,但在抗击病毒的“舞台”上未有过实操。
Ad5-nCoV
Ad5-nCoV与Ad5-EBOV同为腺病毒载体疫苗,2022年5月,WHO将Ad5-nCoV纳入EUL清单,成为中国首 个获WHO紧急使用授权的创新技术路线新冠疫苗,Ad5-nCoV在国内外的大规模应用,让康希诺第一次站上了预防病毒传染的实操“舞台”,且大放异彩。
吸入型Ad5-nCoV的获批,又为康希诺争到了全球首 款吸入用新冠疫苗称号,且入选了英国《卫报》发布的2022年度十项重大科学进展。
与新冠病毒至死不渝的“邂逅”,让康希诺在预防病毒的实操“舞台”上威名远扬,通过海外商业化的经验,在巴基斯坦、墨西哥、马来西亚等多个发展中国家建立疫苗生产基地,此外,还与印尼Etana开展战略合作,涉及结核病疫苗、四价流脑结合疫苗和吸入疫苗技术。
技术路线大升华。除了腺病毒载体吸入型技术路线的创新升华,mRNA技术路线,是康希诺在新冠疫苗上的另一布局,在吸入用Ad5-nCoV还未获批之前,康希诺就将mRNA新冠疫苗推至临床阶段,截至目前已完成临床IIb期试验。
值得注意的是,全球新冠疫情形势的变化,康希诺在mRNA新冠疫苗的进展上放缓了很多,据2022年报显示就已完成临床IIb 期试验,到2023半年报发布之日,仍无实质推进。
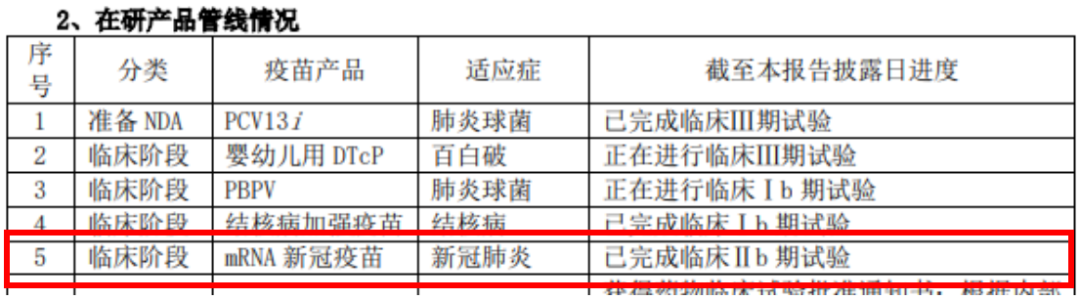
国内首 个获批的mRNA新冠疫苗是石药集团的SYS6006,而康希诺和石药集团都是在2022年4月获批mRNA新冠疫苗临床试验许可,康希诺在mRNA新冠疫苗的落后以及进度的放缓,除了吸入用Ad5-nCoV的“耽误”,还有新冠疫情形势的变化,放缓推进mRNA新冠疫苗也是明智的抉择。
其实,康希诺在mRNA新冠疫苗上的成绩并不主要体现在管线上的进度上,还有建立的 mRNA技术平台及配套的生产基地,康希诺早在mRNA新冠疫苗获批临床的同时,就在上海临港建设mRNA产业化基地,2022年底就已进行了试生产。
作为疫苗企业,丰富的技术路线才是“命脉”,因新冠疫苗而大升华的技术路线,极大提高了康希诺的国际地位,跨国药企巨头之一的阿斯利康在2023年8月,与康希诺签署了长达10年的合作框架协议,正是看中了其在mRNA方面的优势。
02
留得青山在 不愁没柴烧
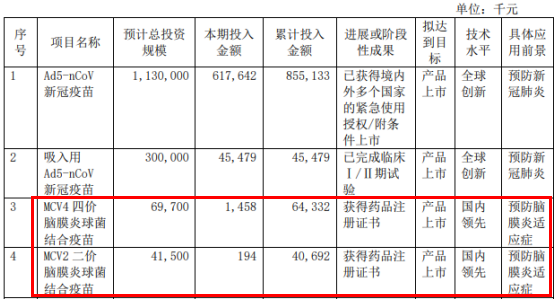
我们要清醒的是,新冠疫苗并不是康希诺的独一“标签”,除了新冠疫苗的成功外,还有2款分别在2021年6月和12月获国家药监局批准上市的脑膜炎疫苗MCV2和MCV4,其中MCV4是我国首 个脑膜炎球菌四价结合疫苗,填补了我国在该领域缺乏高端疫苗的空白,2023年上半年,2款脑膜炎疫苗实现营业约2.23亿元,同比增长1996.88%,市场放量迅速。
其实从收益上来讲,MCV2和MCV4并不弱于新冠疫苗,MCV2和MCV4在2022年的收入约为1.55亿元,截至2023年上半年,上市后的总营收为3.78亿元,而MCV2和MCV4截至获批时的累计投入金额为1.05亿元,上市不到两年就已回收了研发成本,且还有2.73亿元的富余。
PCV13i
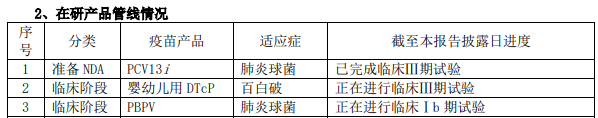
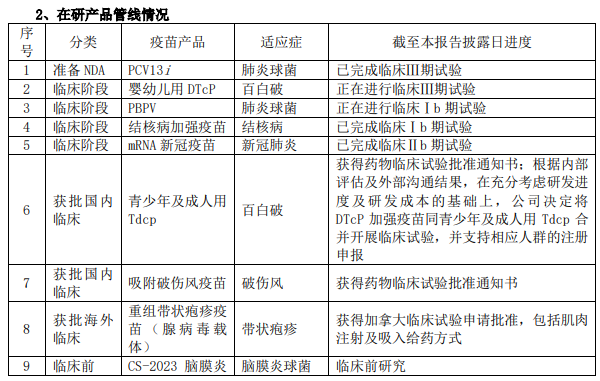
康希诺同时也是国产替代的优秀“选手”,管线产品PCV13i已完成临床III期试验准备NDA,PCV13i是同类产品中唯一CRM197和TT双载体技术,不仅能提高结合率,还可减少与其他疫苗共注射时造成的免疫抑制,有望在国产替代中向全球疫苗销售第2的辉瑞Prevnar系列发起有力一击。另一款同样定位为国产替代的疫苗是婴幼儿用DTcP,截至目前,暂无国内疫苗厂商研发的组分百白破疫苗获批上市。
PBPV
值得一提的还有正处临床Ib期试验的PBPV,是全球创新在研肺炎疫苗,不同于多糖/多糖结合疫苗,采用基于肺炎球菌表面蛋白 A的抗原,对肺炎球菌有更大的覆盖范围。
尽管新冠疫苗成了康希诺目前的“鸡肋”产品,但沉淀的“结晶”价值却是一座“绿水青山”,康希诺通过新冠疫苗海外拓展,得到了国际,特别是东南亚地区的认可,2023年8月,康希诺旗下子公司以1334万元认购Solution约10%股份。
值得一提的是,Solution旗下生物医药子公司SOLBIO成立于2020年,建立了马来西亚第一个BSL2疫苗生产设施。
康希诺加深与海外合作方的关系,正是在为后续产品的出海做铺垫。2023年6月,MCV4年龄拓展(7-59周岁)临床试验获批,康希诺在8月份的投资者关系活动中表示“扩龄的研究成果,能进一步推动国内更广泛人群的使用,以及海外市场的拓展,例如在流脑流行带的海外国家中更有竞争力”。
此外,还有之前因吸入用新冠疫苗与印尼Etana“结缘”的战略合作,吸入给药方式的结核病加强疫苗,正是印尼当地所需,据康希诺2023半年报显示,结核病加强疫苗已完成临床Ib期试验。
不久前,与阿斯利康合作的敲定,又让康希诺多了一个CDMO的“身份”。
mRNA疗法在新冠之后迎来了一束强光,2023年2月,Moderna和默沙东联合开发的mRNA肿瘤疫苗mRNA-4157获美国FDA授予突破性疗法认定,成为全球首 个获该认定的mRNA肿瘤疫苗,据mRNA-4157联合K药治疗黑色素瘤的IIb期试验结果显示,与单独使用K药相比,联合治疗将复发或死亡的风险降低了44%,从临床疗效上看,mRNA-4157并不是预防性疫苗,更像是治疗性药物,mRNA-4157的进展让mRNA疗法突破了疫苗的价值界限。
值得一提的是,阿斯利康对mRNA并不是头一次,很早之前就与Moderna合作开发用于治疗严重心血管、代谢和肾脏疾病以及癌症的mRNAA疗法,2016年7月启动了mRNA疗法项目ZD8601的1期临床试验,EPICCURE试验IIa期结果表明,ZD8601在心力衰竭患者中达到了安全性和耐受性的主要终点,但ZD8601却从阿斯利康官网的管线名单中消失,然而阿斯利康并未放弃mRNA疗法,尽管其mRNA疫苗项目处于早期研究阶段。
不是在研发中爆发,就是在研发中死亡,康希诺此时被阿斯利康相中,也就有了一次与跨国药企同甘共苦的机会。
03
小结
疫情之初,药企以新冠产品论“英雄”,疫情之后,新冠产品业绩可以反转,但“英雄”事迹不能反转,况且康希诺也有不少与生俱来的拿手“好戏”。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57