靶向蛋白降解(Targeted protein degradation, TPD)作为一种新兴的治疗策略被广泛关注,它可以靶向以前被认为“不可成药”的蛋白质。PROTAC是TPD的主要焦点,它同时招募并结合E3连接酶和靶蛋白(POI),从而形成E3-降解蛋白POI三元复合物,诱导POI泛素化和随后的蛋白体降解。
鉴于PROTAC巨大的治疗潜力和独特的机制,该领域引起了学术界和制药行业的极大兴趣,目前已有250种药物被PROTACs进行降解测试。尽管PROTAC具有广泛的治疗潜力,但在人类基因组的数百种E3连接酶中,目前只有不到2%的E3连接酶参与了TPD领域的研究,因此,需要招募更多的E3连接酶来进一步增强TPD的治疗潜力。
近日,美国国家癌症中心的Eytan Ruppin教授和印第安纳大学医学院生物统计与健康数据科学系Leng Han教授团队研究人员对1075个E3连接酶进行了表征,最终确定了76种有潜力的E3连接酶,扩展了PROTAC的E3连接酶版图,推动了PROTACs药物的开发进展。
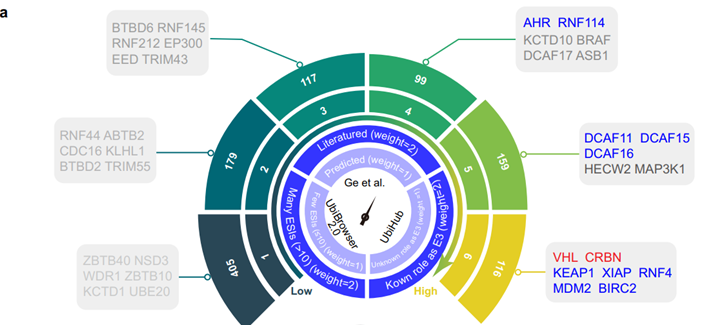
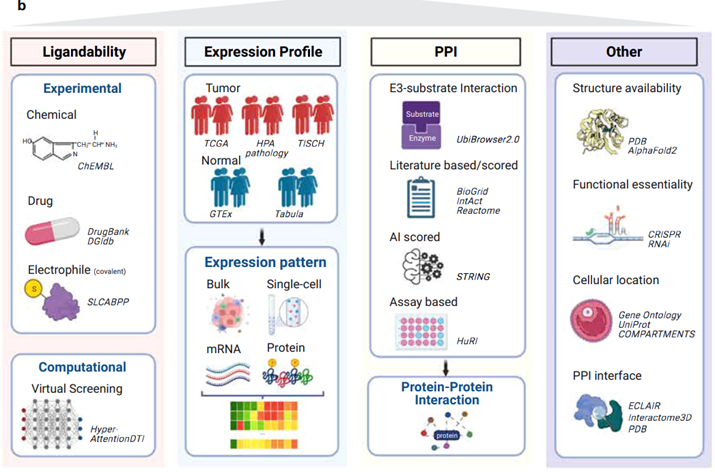
研究人员收集了E3连接酶的综合列表(图1a),并利用大规模数据资源、实验证据和人工智能(AI)工具来描绘E3连接酶的七个不同的关键维度:
化学配位性,表征E3连接酶的粘合剂可用性;
E3连接酶在肿瘤和正常样本中单细胞水平和整体水平的表达模式;
进一步表征其潜在蛋白靶点的E3连接酶的PPI;
在PROTAC设计中应优先考虑的其他重要因素,包括结构可用性、功能必要性、细胞定位和E3连接酶的PPI接口(图1b)。
之后,他们基于三十个大规模数据集分析,包括3个E3连接酶列表、5个配体库、5个表达图谱、7个互作数据库、2个结构数据库、2个重要性筛选、3个细胞定位数据库和3种互作界面数据库,研究人员揭示了几种有前途的现存的E3连接酶。
PART.
01
化学配位性
表征E3连接酶的粘合剂可用性
为了寻找可能促进E3连接酶募集的新的药物,研究人员采用基于深度学习的虚拟筛选配体模型HyperAttentionDTI31,在DrugBank25中搜索E3连接酶与药物之间潜在的相互作用。
在评估和应用该模型后,研究人员获得了预测的药物-靶标相互作用,包括潜在的新型E3连接酶,如Makorin Ring Finger Protein 1 (MKRN1),与关键肿瘤驱动因子TP53和APC32具有ppi,并预测与DB13955(雌 二醇二酸酯)和DB03017(月桂酸)相互作用。利用这些药物可能会增加潜在的新型E3连接酶的配体性,从而靶向其他肿瘤靶点。他们系统分析利用了五个大规模的数据源,并揭示了许多新的E3连接酶和数十种可用的配体,这些配体可能用于PROTAC的开发。
PART.
02
E3连接酶在肿瘤和正常样本中
单细胞及整体水平的表达模式
通过对肿瘤和正常组织的整合分析,研究人员确定了206个E3连接酶,包括3个增选的和203个新的E3连接酶,它们在TCGA和HPA病理中至少一种肿瘤类型中高表达,而在GTEx和Tabula及大多数正常组织中低表达。除了这3种被采用的E3连接酶,这203种潜在的新型E3连接酶揭示了一个大型的E3连接酶库,可用于抗癌PROTAC的开发。
研究人员全面描绘了大细胞水平和单细胞水平的转录组表达,以及E3连接酶的蛋白质组表达,证明了利用大规模表达数据进一步推进PROTAC提高疗效和规避副作用的必要性。
PART.
03
E3连接酶与POI蛋白
相互作用(PPI)的综合图谱
蛋白质被PROTAC降解的可能性因靶蛋白而异,总结E3连接酶相关的ppi应优先考虑能被PROTAC高降解的靶蛋白。为了确定这些PROTAC靶点,研究人员将PROTACtable基因组和基于模型的蛋白质降解性分析(MAPD)两项研究的结果结合起来,对靶点的PROTACtable可降解性进行了评估。这两项研究突出了3280个PROTAC可处理靶点,其中1025个靶点重叠。
研究人员还发现了一些PPIs涉及PROTAC可治疗的癌症靶点,这些靶点尚未在PROTAC中被探索。例如,神经母细胞瘤RAS(NRAS)与转移性结直肠癌的不良预后相关,有证据表明PPIs具有增选的E3连接酶BIRC2和XIAP,以及潜在的新型E3连接酶CDC20和SKP2。另一个PROTAC可处理的靶点是Rac Family Small GTPase 1 (RAC1),它诱导乳腺癌的化疗耐药,与增选的E3连接酶MDM2和XIAP以及潜在的新型E3连接酶ITCH和SMURF2相互作用。在开发针对这些癌症靶点的PROTACs时,可以考虑相应的E3连接酶。
PART.
04
E3连接酶的结构可用性、
功能必要性、细胞位置和PPI接口
首先,为了获得E3连接酶的可用蛋白质结构,研究人员查询了世界范围内的结构数据库protein Data Bank (PDB),鉴定出414个具有实验确定结构的E3连接酶。这些可用的蛋白质结构,为招募潜在的新E3连接酶提供了很好的机会。
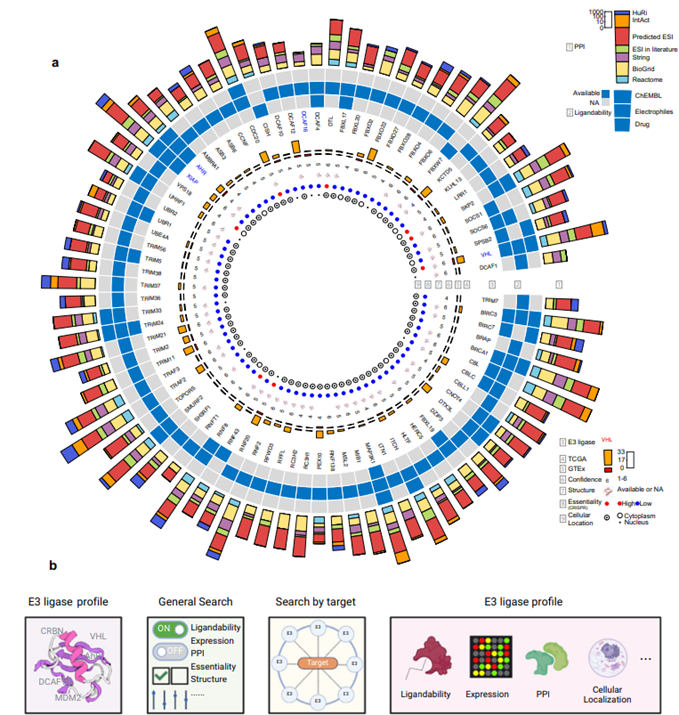
然后,研究人员利用依赖图谱(DepMap)61中的CRISPR和RNAi技术,研究了E3连接酶的遗传扰动,评估了癌细胞系中基因的必要性。他们在CRISPR筛选中鉴定出146个肿瘤必需的E3连接酶,包括两个增选的E3连接酶——VHL和RNF4。
紧接着,为了确定E3连接酶的细胞位置,研究人员整合了来自COMPARTMENTS、Gene Ontology (GO)和UniProt的高质量数据。发现983个E3连接酶被细胞质和/或细胞核注释,这被认为是PROTAC的首选位置。这些潜在的新型E3连接酶,为实现受限或需要降解的亚细胞定位提供了一种通用的选择。
最后,研究人员从多种来源收集到跨越928个E3连接酶,包括11个增选的E3连接酶的PPI界面。基于此可以指导人们确定E3连接酶或靶标中观察到的突变是否位于界面区域,从而可能进一步破坏E3连接酶与靶标的相互作用。
PART.
05
局限与展望
然而,此研究目前也有一定的局限性,首先针对E3连接酶的研究主要集中在有限数量的E3连接酶上,如VHL/CRBN,缺少其他蛋白经验;其次由于目前缺乏大规模的单细胞蛋白质组学数据,无法更高分辨分析E3连接酶的活性,最后翻译后修饰(PTM)在调节E3连接酶的活性和丰度(丰度指的是E3连接酶的相对含量)方面也起着关键作用。
PTM对PROTAC中E3的调控作用在很大程度上是未知的,大规模的高分辨率PTM数据还无法实现。因此,该网站为用户提供了根据他们的偏好选择数据源的选项。除了为PROTAC寻找新的E3连接酶外,E3连接酶的信息也可以被其他TPD领域所利用,如蛋白水解靶向抗体(PROTAB)和分子胶。
总之,该研究通过分析30个大规模数据集,从7个不同的方面系统地表征了E3连接酶,包括化学配体性、表达模式、蛋白质-蛋白质相互作用(PPI)、结构可用性、功能必要性、细胞位置和PPI接口。揭示了几种有前途的现存的E3连接酶。综合置信度评分、配位性、表达模式和PPI,确定了76个E3连接酶作为PROTAC相互作用的候选酶。
此外,尽管新开发的PROTAC大部分用于癌症治疗,但研究人员对E3连接酶的综合分析也可以从癌症转移到其他领域的治疗开发,例如:治疗神经和/或免疫疾病。期待E3连接酶能够持续助力PROTAC药物的开发,造福更多患者!



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57