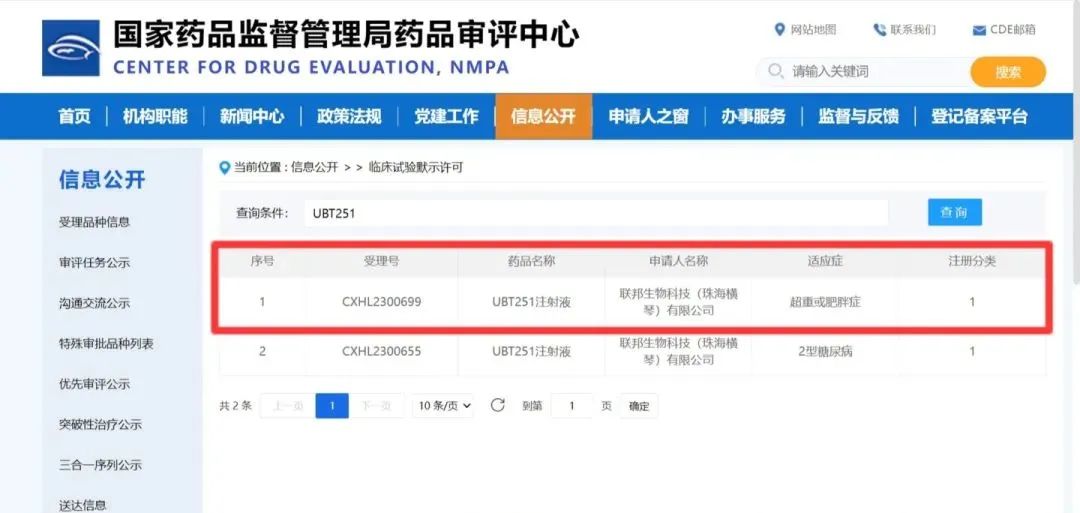
9月1日,联邦制药UBT251注射液继8月29日获得国家药品监督管理局关于2型糖尿病适应症临床默示许可之后,又获得关于超重或肥胖适应症的临床默示许可,受理号为CXHL2300699。
UBT251是一款长效多肽类药物,可同时激动GLP-1/GIP/GCG三靶点受体。UBT251可通过作用于GLP-1受体、GIP受体和GCG受体促进胰岛素分泌,调节食欲和能量代谢,降低血糖和体重,改善肝脏脂肪变性。临床前多种动物模型研究结果显示,UBT251显著降低血糖和体重,改善肝脏脂肪变性和纤维化,模型动物体内治疗效果优于已上市的GLP-1受体单靶点药物司美格鲁肽(Semaglutide)及GLP-1/GIP双靶点药物替尔泊肽(Tirzepatide)。
目前,公司是国内首家、全球第二家以化学合成多肽法制备的长效GLP-1(胰高血糖素样肽-1)/GIP(葡萄糖依赖性促胰岛素多肽)/GCG(胰高血糖素)三激动剂获批临床的企业。该产品的成人2型糖尿病适应症已于2023年8月29日获批临床,此外非酒精性脂肪肝/非酒精性脂肪肝炎适应症的临床注册申请处于最后审评阶段。
预期本产品每周皮下注射给药1次,针对2型糖尿病、超重/肥胖及非酒精性脂肪性肝炎等多种代谢紊乱疾病患者的治疗有很好的获益。现时,国内、外相同靶点药物研发进展最快为刚宣布启动临床III期研究。
后续,联邦制药将持续推动UBT251(GLP-1/GIP/GCG三激动剂)在能量代谢相关疾病领域的研究(如糖尿病、肥胖、非酒精性脂肪肝病等),造福广大慢性疾病患者。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57