11月23日,国家药监局药审中心发布关于公开征求《药物临床试验参与方的安全信息报告与风险沟通交流技术指导原则》意见的通知,并附《药物临床试验参与方的安全信息报告与风险沟通交流技术指导原则(征求意见稿)》(以下简称《征求意见稿》)、起草说明以及征求意见反馈表。
《征求意见稿》的起草目的如下:
药物临床试验期间参与方的安全信息流转和风险沟通交流是保护临床试验受试者安全的重要内容。ICH E2A 指导原则明确了临床试验安全信息快速报告的相关要求,2020 版《药物临床试验质量管理规范》(GCP)中也强调了申办者、伦理委员会、临床试验机构以及研究者在药物临床试验期间中安全信息收集、评价、递交和报告环节中的责任与要求。
在临床试验安全信息报告与风险评估的实践过程中发现,由于药物临床试验参与方对《药物临床试验质量管理规范》(GCP)中有关安全性报告和风险沟通的报告主体、职责和流转流程存在不同理解与解读,造成临床试验申办者、研究者、伦理委员会、临床试验机构和监督管理机构间的安全性报告与风险评估存在运行不畅问题。例如,报告主体、报告时限、安全评估等。
另外,在疫苗国家监管体系(NRA)认证过程中,认证专家建议监管机构应与伦理委员会、临床试验机构就重要的临床试验期间安全性报告审核保持直接的沟通。
本指导原则旨在规范药物临床试验期间参与方包括申办者、伦理委员会、临床试验机构、研究者和监督管理部门安全性报告流转和风险沟通交流,明确各方职责,更好地保护临床试验受试者的安全。
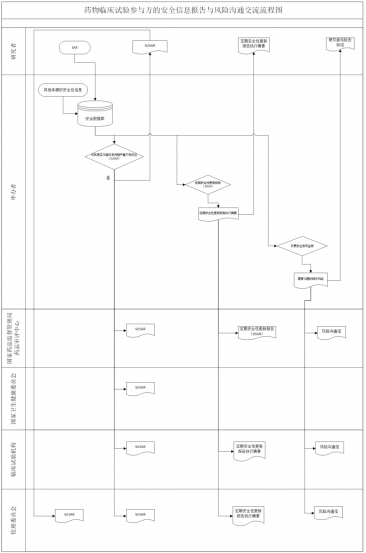
《征求意见稿》的主体内容共五章,详细介绍了药物临床试验期间参与方包括申办者、伦理委员会、临床试验机构、研究者和监督管理部门安全性报告流转和风险沟通交流,明确各方职责,更好地保护临床试验受试者的安全。具体如下:

第一章概述,主要介绍了本指导原则起草目前主要内容等总体内容,包括目的依据、主要内容等。
第二章主要明确了药物临床试验期间研究者和研究机构的安全性报告的基本要求。包括了报告严重不良事件的科学要求、报告时限、紧急风险报告和其他重要不良事件的要求等主要内容。
第三章主要明确了药物临床试验期间办者安全性报告和风险沟通。包括了申办者向研究者的安全性报告和风险沟通、申办者向伦理委员会和临床试验机构的安全性报告等主要内容。
第四章为伦理委员会对安全信息报告的接收、审查和意见传达。
第五章主要明确了药物临床试验机构接收申办者和研究者的安全性报告和风险沟通。
此外,《征求意见稿》还附有临床试验期间参与方安全性报告和风险沟通流程图以及参考文献。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57