11月24日,云顶新耀宣布,布地奈德迟释胶囊(Nefecon,中文商品名:耐赋康)的新药上市申请已正式获批,用于治疗具有进展风险的原发性免疫球蛋白肾病(IgA肾病)成人患者。
从创立到港股上市,三年期间,云顶新耀引进了8款FIC和BIC管线候选物,利用license-in模式,云顶新耀构建了强大的管线阵容,获得市场广泛关注。
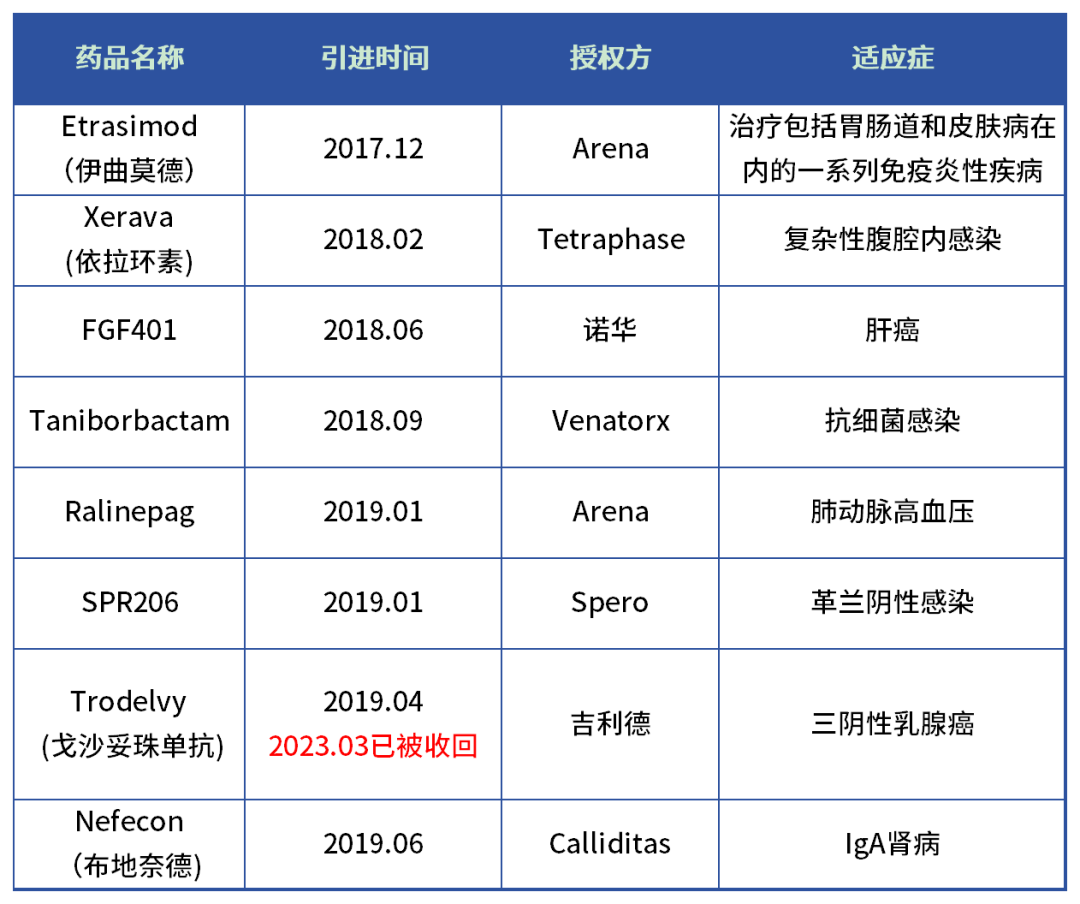
今年3月,依拉环素获NMPA批准,7月成为正式商业化上市,成为云顶新耀的在国内上市的第一款产品,现如今, 耐赋康又获批上市,同时其他多款引进药物逐渐接近收获期,在市场对license-in模式和产品存疑之时,云顶新耀正在以“云顶速度”迈进商业爆发阶段。一直被市场寄予厚望的耐赋康,能成为云顶新耀的爆款吗?
IgA肾病的独家“猎手”
IgA肾病作为全球最常见的原发性肾小球肾炎,其也是导致慢性肾脏病(CKD)和终末期肾脏病(ESRD)的重要原因,IgA肾病的发病有明显的地域差别,其中在亚洲人群中发病率最高,而中国是世界上IgA 肾病发病数量最大的国家。
耐赋康®上市之前,全球经批准的IgA 肾病治疗方法有限,现存的可及药物主要为仿制药,可用药物包括降压药或为超适应症用药,其中RAS阻断剂(普利和沙坦类),是目前IgA肾病的一线治疗方案,此外还包括糖皮质激素、霉酚酸酯等传统方案。
这些全身性类固醇和免疫抑制剂具有不良的副作用并且不适合患者长期使用,即使经过治疗,50%的IgA 肾病患者仍将在30年内发展成为终末期肾病,当前缺少从疾病源头改变疾病进展的针对性方法,即对因治疗,针对IgA 肾病的创新药很稀缺,Ig A肾病患者的治疗现状存在巨大的未满足医疗需求。
耐赋康®是全球首 个IgA肾病靶向对因治疗药物,专为治疗IgA肾病而研制。每粒迟释胶囊含布地奈德4mg,通过特殊的制作工艺,靶向作用于回肠末端的黏膜 B 细胞(包括派尔集合淋巴结),胶囊溶解后,三层包衣微丸持续稳定释放布地奈德,高浓度覆盖整个靶区域,从而减少诱发 IgA 肾病的Gd-IgA1产生,进而在发病机制上游阶段治疗IgA肾病。
此次耐赋康®全球性III期研究(NefIgArd)取得鼓舞人心的结果,凸显了这一针对疾病源头的首 创疗法的科学性及重要性。确证的长期eGFR获益及蛋白尿的持续下降反映了耐赋康®通过针对疾病源头的作用机制,提供了差异化的改变疾病进展的治疗方案,从而达到延缓肾功能下降的治疗作用,能减少50%肾功能下降,延缓超过10年进展至透析或肾移植。
耐赋康®已于2021年12月获得FDA加速批准上市,2022年7月又获得EMA附条件上市许可批准,2023年10月底在中国澳门获批上市,如今国内获批,耐赋康®成为了首 个同时被FDA、EMA、NMPA三大权威药监机构批准用于治疗IgA肾病的创新药物,也是第一款被中国药监局纳入突破性治疗品种的非肿瘤药物。
而这样一款“宝藏”药品能成为云顶新耀的囊中之物,确实离不开云顶新耀独特的前瞻性的眼光和布局。早在2019年6月,云顶新耀就与Calliditas签订独家授权合约,引进耐赋康在中国( 包括香港、澳门、台湾地区 )和新加坡开发以及商业化的权利,2022年3月,进一步将韩国纳入云顶新耀的授权许可范围 ,也就是说只用4年的时间,云顶新耀就成为国内唯一一家拥有全球首 个IgA肾病靶向药的独家药企。
耐赋康®能成为云顶的最大催化剂?
根据弗若斯特沙利文数据,2030年全球IgA肾病患者总数或将达到1020万人;全球半数以上的患者集中在东亚地区,其中仅中国市场就有约400万~500万的患者,而国内至今只有耐赋康®获批上市,手握耐赋康®大中华区、韩国及新加坡权益的云顶新耀,覆盖了全球近一半的患者群体。
庞大的患者人群孕育着巨大的市场,根据弗若斯特沙利文的数据,全球IgA肾病治疗药物市场保持快速增长,预计从2020年的5.67亿美元增至2025年的11.96亿美元,2020年至2025年复合年增长率达16.1%。中国的IgA肾病治疗药物市场预计也将从2020年的0.37亿美元增至2025年的1.09亿美元,复合年增长率达24.6%。
已经上市产品中,从全球范围看,耐赋康目前阶段已是当之无愧独占鳌头。
不过眼下全球多个针对IgA肾病的在研新药正蓄势待发,形成了一股潜在的竞争力,从作用机制来看,可以分为肠道黏膜免疫调节剂(布地奈德肠溶胶囊)、B细胞抑制(BAFF/APRIL)、补体抑制剂和非免疫支持治疗(ETA/SGLT-2i)等几类。根据药智数据库统计,目前全球关于IGA肾病的新药管线接近50条,近10款新药处于了全球临床III期,国内领域就有6个新药进入临床III期。
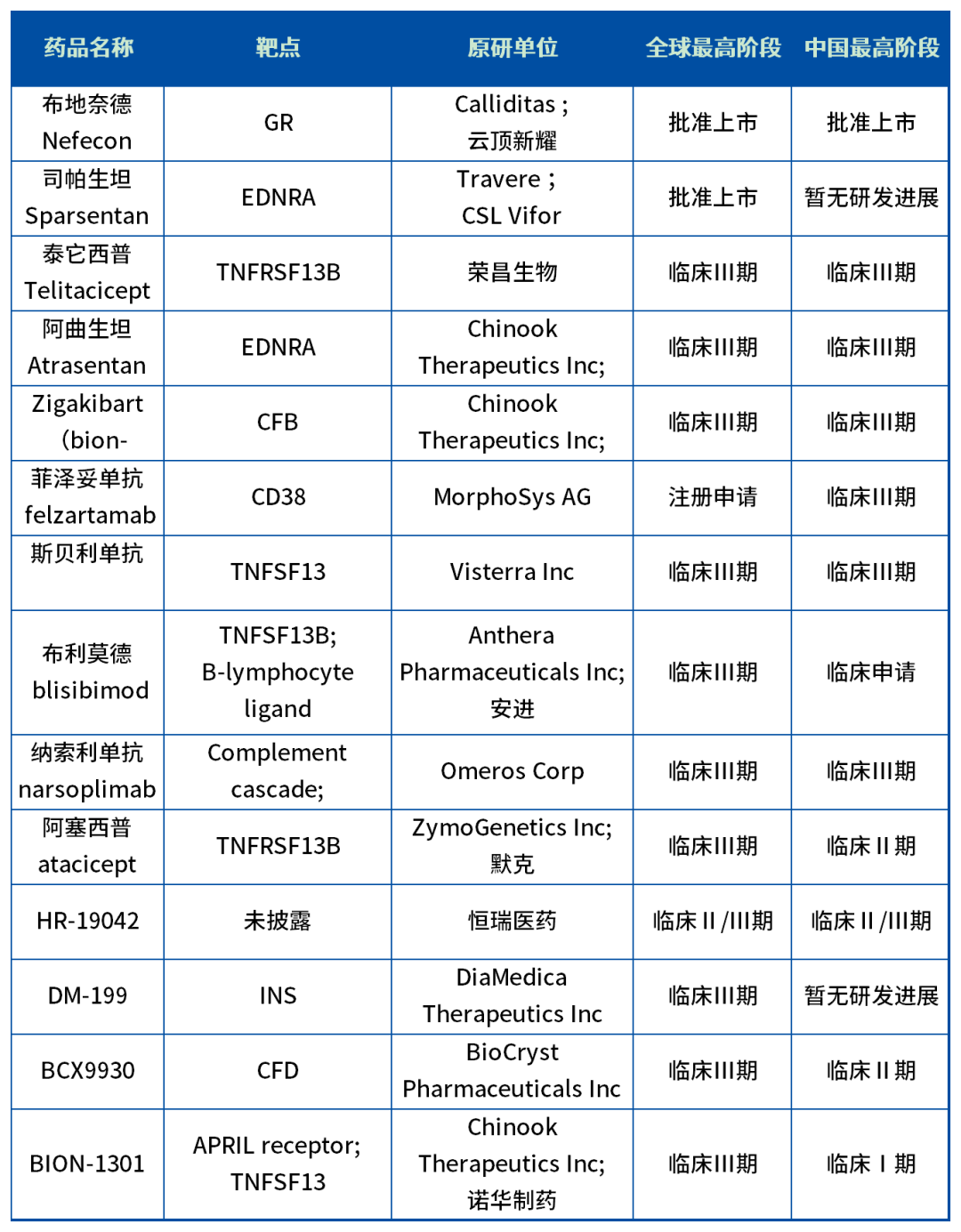
其中荣昌生物的BlyS/ARPIL融合蛋白(泰它西普)是国产在研IgA肾病新药进展最快的管线,2021年3月泰它西普在国内上市用于治疗系统性红斑狼疮,泰它西普治疗 IgA 肾病的 II 期临床研究(登记号:NCT04291781)数据在 2021 美国肾脏病学会年会上亮相。
试验结果显示,用药 24 周后,泰它西普 240 mg 组受试者尿蛋白水平与基线相比显著降低,24 小时尿蛋白平均水平较基线下降了 49%,相对于安慰剂组有统计学意义(p<0.05)。研究表明,泰它西普减少了高风险 IgA 肾病患者的蛋白尿,能够有效降低 IgA 肾病的进展风险,且安全性良好。
基于此,FDA 已在 2022 年 11 月批准泰它西普在美国开展该适应症的 Ⅲ 期临床试验,今年初在国内也启动IGA肾病的III期临床。
除荣昌生物,诺华在国内IgA 肾病领域的研发也是走在前列。今年6月,诺华高调切入IgA肾病领域,以35亿美元总价款收购Chinook Therapeutics,将Chinook旗下两款用于治疗IgA肾病的新药Atrasentan(口服内皮素)和Zigakibart(April单抗)收入囊中。目前Atrasentan和Zigakibart全球和中国都进展到Ⅲ 期临床。
Atrasentan的二期临床试验中,患者经治疗12周后UPCR降低48.3%,治疗 24周后UPCR降低了54.7%,2023年10月30日,诺华宣布Atrasentan的关键 III 期ALIGN 研究的中期分析结果积极:研究达到主要疗效终点,IgAN患者中的蛋白尿具有统计学意义的显著减少;整体安全性及耐受性良好,诺华计划于 2024 年向FDA提交加速批准申请。
另外,Zigakibart在2023 ERA年会上公布的一项I/II期临床研究(NCT03945318)中期分析结果显示,对于已接受稳定剂量的RASi标准治疗3个月以上或不耐受RASi且存在疾病进展风险的IgA肾病患者,zigakibart治疗可快速,持续地降低蛋白尿,在100周降幅达72%,同时具有良好的安全耐受性。
目前诺华和荣昌生物的IgA肾病新药都已进展到临床后期,而且都展现了优于耐赋康®的潜力,耐赋康®未来面临的竞争势必没有当下轻松。
不过耐赋康®在中国上市,一定时间的市场独占期自然有,根据华安证券的预测,2023到2025年,耐赋康®在国内的销售收入将分别为2.87亿元、5.31亿元、9.63亿元,是云顶新药近两年最大的业绩催化剂。
总而言之,现阶段的IgA肾病市场想象空间巨大,众多药企同台竞技已是必然,但就当下,面对巨大的市场机会和寥寥无几的竞争对手,耐赋康®作为国内IgA肾病的一枝独秀,能否助云顶新耀开启疯狂的“吸金”模式,拭目以待。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57