今年以来,Claudin 18.2靶向药赛道跑出“加速度”。
在安斯泰来提交Zolbetuximab上市申请后不久,创胜集团的Osemitamab(TST001)和奥赛康药业的ASKB589这两款疗效优异的国产Claudin 18.2单抗,就相继获批开展一线治疗胃癌的Ⅲ期临床试验。
此外,国产药企还在研发靶向Claudin 18.2的双抗、ADC、CAR-T疗法等各种产品类型。
01
国产围攻光明顶,
大有“三强争霸”之势
尽管目前全球尚无Claudin 18.2单抗获批上市,但已经隐约出现“三强争霸”的局面。
若无意外,安斯泰来已经递交上市申请的Zolbetuximab(佐妥昔单抗,简称Z药),或将成为全球首 款获批的Claudin 18.2靶向药。
2023年7月,Zolbetuximab的BLA申请获FDA受理并授予优先审评资格,PDUFA日期为2024年1月12日,用于一线治疗Claudin 18.2阳性、HER2阴性的局部晚期不可切除或转移性胃或胃食管交界处(G/GEJ)腺癌;8月,国家药监局也受理了Zolbetuximab治疗GEJ腺癌患者的上市申请。
可没过几个月,两款国产Claudin 18.2单抗就相继获批开展Ⅲ期临床,紧盯对手。
2023年10月,创胜集团宣布FDA批准公司开展Osemitamab(TST001)联合纳武利尤单抗及化疗作为一线治疗HER2阴性、Claudin 18.2表达的G/GEJ患者的全球III期临床试验。
紧接着,奥赛康的美国子公司AskGene宣布NMPA批准开展ASKB589注射液或安慰剂联合CAPOX(奥沙利铂和卡培他滨)及PD-1抑制剂一线治疗Claudin 18.2阳性的G/GEJ患者的III期关键性临床试验。
这正是创新药市场的看点:虽然抢占先发优势,但并不意味着就能一劳永逸。毕竟,除了临床推进速度以外,两款国产Claudin 18.2单抗的疗效均不弱于Zolbetuximab。
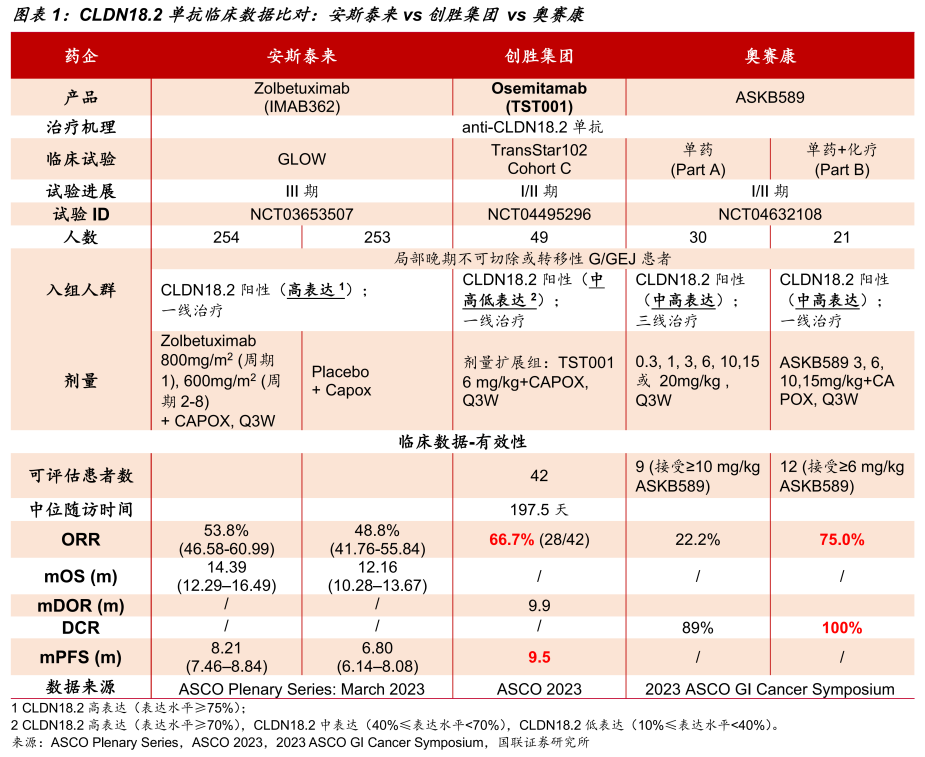
虽然都是采用Claudin 18.2单抗+CAPOX(卡培他滨+奥沙利铂)的治疗方案,但Zolbetuximab和TST001的获益人群存在差异。
Zolbetuximab的III期研究只对Claudin 18.2高表达人群有效,而TST001在结构上进行了独特的设计(通过Fc糖基化改造降低了Fc区岩藻糖水平,从而增加了与FcγRIIIa的结合能力,增强了由NK细胞介导的ADCC效应),不仅亲和力更高,而且对Claudin 18.2高、中低表达患者依然有效,覆盖人群更广,具备BIC(同类最 佳)潜力。
另外,TST001还在非头对头比较Zolbetuximab临床数据中展现了更佳的疗效,两者的客观缓解率(ORR)分别为66.7%、53.8%,中位无进展生存期(mPFS)分别为9.5个月、8.2个月。
奥赛康的ASKB589是ADCC增强型第二代抗Claudin 18.2单抗,在分子设计和细胞株构建上采用去岩藻糖技术,对Claudin 18.2的亲和力和特异性更高,转化为更强的抗体依赖细胞介导毒作用(ADCC)和补体依赖的细胞毒性作用(CDC),早期数据显示出BIC潜力。
据公司公告显示,ASKB589已开展包括单药、联合化疗、联合PD-1抑制剂及化疗的多项I/II期临床研究,累计治疗超过200例胃癌患者。
在ASKB589临床II期扩组研究中,有可测量病灶且至少有过一次治疗后肿瘤评估的具Claudin 18.2中高表达的患者接受了6mg/kg或10 mg/kg的ASKB589联合CAPOX治疗,经研究者确认的客观缓解率(cORR)为79.2%,疾病控制率(DCR)达95.8%。
面对两名国产药企“猛将”的夹击,相信安斯泰来紧迫感十足。
02
多技术路线并行,
后浪誓要拿下第一
胃癌是全球常见的癌症之一,存在巨大未被满足的临床需求。
据公开数据显示,全球每年胃癌新发病例约108.9万例,死亡病例达76.9万例,发病率位列恶性肿瘤发病率的第5位,死亡率的第4位。而我国胃癌新发病例约48万例,死亡病例约37万例,分别占全球胃癌新发和死亡病例的44%和48.6%。
另外,我国胃癌发病率仅次于肺癌居第2位,5年总体生存率仅为35.1%,市场亟需更多创新的治疗方案。Claudin 18.2靶向药就是其中之一。
Claudin 18.2是一种泛癌靶点,在胃癌、胰腺癌、胆囊及胆道癌、食管癌等多种类型的癌症中过表达,其中在胃癌中Claudin 18.2表达率最高。
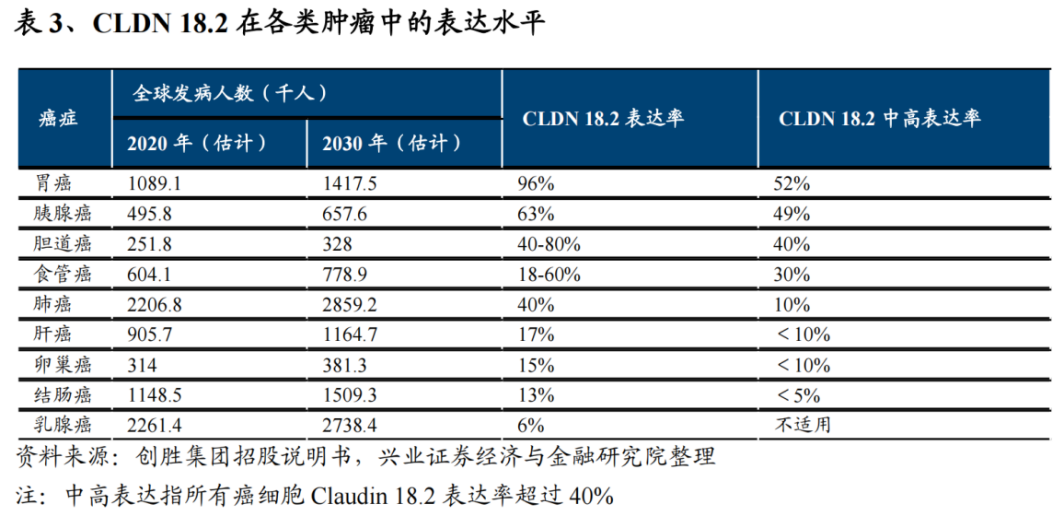
广阔的市场潜力叠加全球尚无Claudin 18.2靶向药获批,让众多国产药企争相涌入这一蓝海市场,产品类型包括单抗、双抗、ADC和CAR-T疗法等,几乎囊括所有主流技术路线。
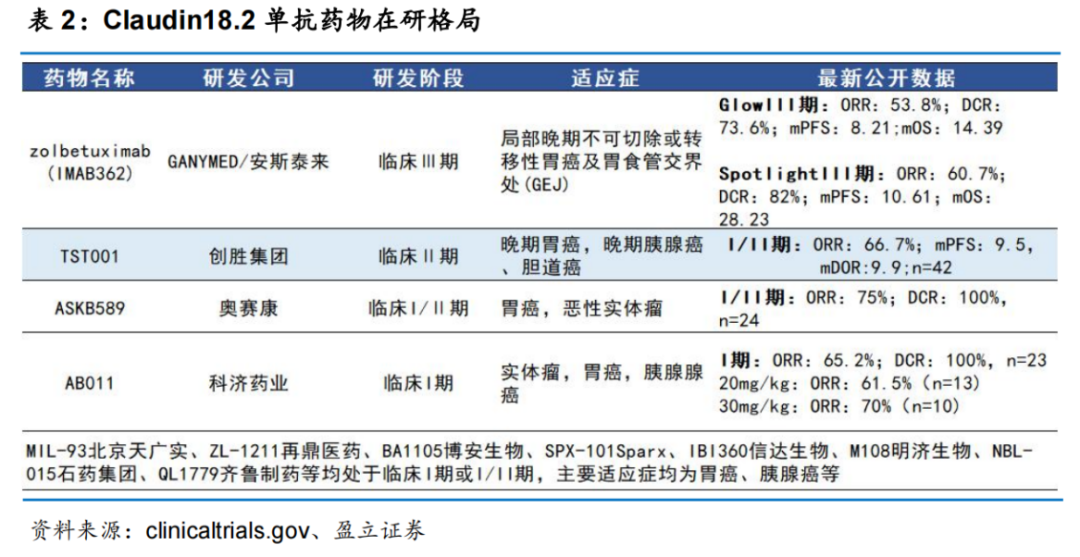
据华创证券研报,进入临床阶段的国产Claudin 18.2单抗已超过10款,包括博安生物BA1105、君实生物JS012、石药集团NBL-015和信达生物IBI360等,均处于临床早期阶段。
博安生物的BA1105为抗体依赖细胞介导毒作用(ADCC)增强型Claudin 18.2单抗,正在国内开发针对消化道癌症的Ⅰ期临床,预计2023年底完成SAD试验。
CAR-T细胞疗法方面,科济药业、传奇生物和凯地生物都布局了2条管线,信达生物也布局了1款产品。
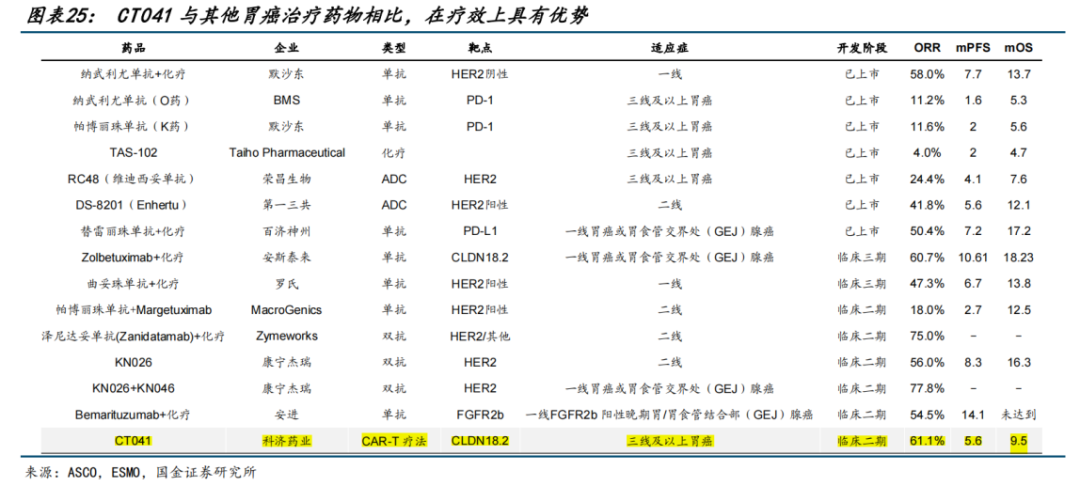
根据I期试验结果显示,科济药业的CT041针对三线及以上胃癌患者的ORR达到61.1%,mPFS为5.6m,mOS为9.5m,较现阶段获批的PD-1单抗和ADC药物的疗效有明显提高。
双抗方面,涉及Claudin 18.2/CD3、Claudin 18.2/CD47和Claudin 18.2/4-1BB等靶点,布局者包括天境生物、信达和百济神州等近10家国内药企,但管线进度多为临床I期。
例如,天境生物与韩国ABL Bio合作开发的TJ-CD4B/ABL111,就是一款同时靶向在多癌种特别是胃癌和胰腺癌中高度特异表达的Claudin 18.2和T细胞共刺激分子4-1BB的创新双抗,在Claudin 18.2低表达的情况下,仍能与肿瘤病灶结合,具有治疗Claudin 18.2低表达癌种的潜力,于2022年3月获FDA授予治疗胃癌(包括胃食管交界处癌)孤儿药资格认定。
03
密集出海,
Claudin 18.2 ADC前景可期
在诸多Claudin 18.2技术路线中,ADC研发的火热程度与单抗相当,而且已经有不少国产Claudin 18.2 ADC授权海外药企。
根据华创证券研报显示,目前国内已有超10款Claudin 18.2 ADC处于临床阶段,涉及康诺亚、恒瑞医药、荣昌生物、石药集团、科伦博泰和君实生物等;信达再次参与其中,布局了所有主流技术路线。
康诺亚CMG901
2023年ASCO大会上,康诺亚公布了CMG901治疗晚期胃癌/胃食管结合部腺癌的的I期临床研究最新数据:89例可评估的Claudin 18.2阳性胃癌或胃食管结合部腺癌患者在三个剂量组的确认的客观缓解率(ORR)为33%,确认的疾病控制率(DCR)为70%。其中,2.2mg/kg剂量组确认的ORR为42%,中位无进展生存期(mPFS)为4.8个月,中位总生存期(mOS)尚未达到。
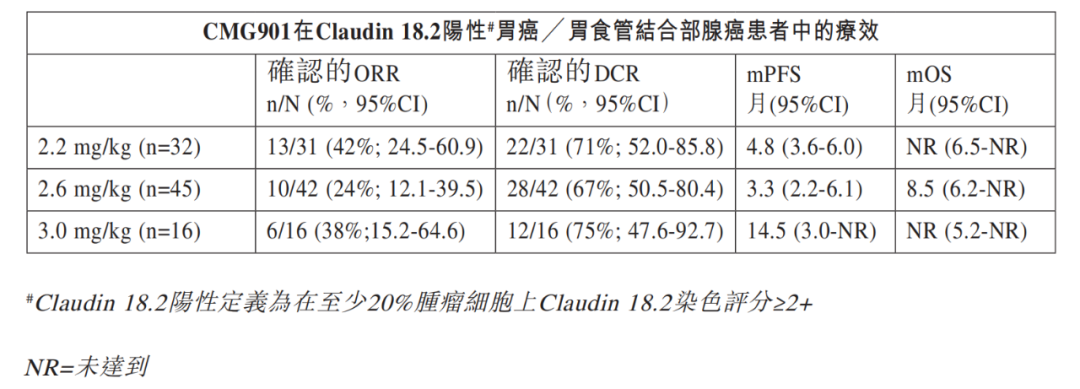
基于亮眼的疗效,CMG901不仅获得了FDA孤儿药资格认定、快速通道资格认定,以及CDE突破性治疗药物认定,还获得了跨国制药巨头阿斯利康的青睐。
2023年2月,康诺亚就CMG901的全球开发权益与阿斯利康达成最高可达12亿美元的交易,而且在上半年收到6300万美元的首付款后,公司总营收同比大增227%,股东应占溢利更是同比增长7.6倍。
石药巨石生物SYSA1801
石药集团附属公司石药巨石生物研发的SYSA1801,在2023年ASCO大会上公布了治疗CLDN18.2表达晚期恶性实体瘤患者的I期临床研究成果,展现了良好的抗肿瘤活性。
截至2022年11月5日,共有33例受试者入组,包括26例胃癌和7例胰腺癌。21例受试者可评估疗效,其中包括17例胃癌受试者,胃癌人群的ORR和DCR分别为47.1%(95%CI 23.0-72.2%,8PRs)和62.7%(95%CI 38.3-85.8%,3SDs)。
2022年7月,石药巨石生物将SYSA1801大中华区以外地区的权益以约12亿美元的价格授权给Elevation Oncology。
此外,已经授权海外药企的国产Claudin 18.2 ADC,还有科伦博泰将SKB315的全球商业化开发权益以9.3亿美元总交易金额授予默沙东,礼新医药将LM302在全球除大中华区及韩国以外的权益以总金额超过10亿美元授予Turning Point。
荣昌生物在研的RC118,除了单药治疗Claudin 18.2表达阳性患者的局部晚期不可切除或转移性恶性实体瘤I期临床试验以外,还获CDE批准开展联合PD-1单抗在该适应症的Ⅰ/Ⅱa期临床研究。
德琪医药研发的ATG-022,正在澳大利亚和中国开展晚期或转移性实体瘤患者的I期试验,2023年5月获得美国FDA先后授予两项孤儿药资格认定,分别用于治疗胃癌及胰腺癌。
04
结语
综上可见,安斯泰来Z药不仅面临两款疗效优异的国产Claudin 18.2单抗的挑战,还要受到其他国产药企在双抗、ADC和CAR-T疗法等技术路线的围攻。
尤其是研发火热且频频出海的国产Claudin 18.2 ADC,其中有不少实力强劲的知名药企入局,期待后续更多亮眼数据读出。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57