12月6日,诺华宣布FDA批准其Fabhalta® (iptacopan)上市,用于治疗成人阵发性睡眠性血红蛋白尿症(PNH)患者。据了解,该药物是FDA批准的首 款口服单药治疗成人PNH药物。

PNH是一种后天获得性溶血性疾病,该病源于造血干细胞PIG-A基因突变引起一组通过糖肌醇磷脂(GPI)锚连在细胞表面的膜蛋白的缺失,导致细胞性能发生变化。异常细胞缺乏GPI连接蛋白,从而对补体敏感,也因而引起相应的临床现象。血管内溶血、潜在的造血功能衰竭和血栓形成倾向是其3个主要临床表现。PNH没有先天发病的报道(先天性CD59缺乏除外),也没有家族聚集倾向。
目前,全球获批治疗PNH的补体C5抑制剂药物仅有Soliris (eculizumab)、和Ultomiris (ravulizumab),这两款药物均由阿斯利康开发,通过静脉注射给药。然而,尽管抗补体C5疗法是既往国际公认的PNH标准治疗,但在抗C5治疗后,仍有大部分患者有残留贫血、疲乏和输血依赖,严重影响生活质量。Iptacopan是诺华开发的一种靶向替代补体途径的B因子抑制剂,同时是FDA批准的首 款口服单药治疗成人PNH药物。
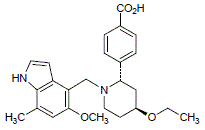
据诺华新闻稿显示,本次批准主要是基于III期APPLY-PNH研究,该研旨在评估每日两次口服 iptacopan 治疗 PNH 的疗效和安全性。结果显示,iptacopan 在提高血红蛋白水平和避免输血方面优于继续使用抗C5疗法治疗的患者。此外,本次批准还得到了III期临床试验APPOINT-PNH的支持,该研究针对未接受过补体抑制剂治疗的患者。

此前,Iptacopan已获得FDA PNH突破性疗法资格认定、FDA C3G(C3肾小球病)突破性疗法资格认定、FDA和EMA的PNH和C3G孤儿药资格认定、EMA的C3G优先药品资格认定和EMA的IgAN(IgA肾病)孤儿药资格认定。此外,Iptacopan还被行业媒体Evaluate列为10款值得关注的潜在重磅疗法之一。
今年10月,诺华宣布了III期APPLAUSE-IgAN研究(NCT04578834)第9个月预设中期分析的积极顶线结果,显示Iptacopan在减少IgA肾病患者的蛋白尿方面优于安慰剂。诺华计划基于中期数据在2024年向FDA寻求加速批准,APPLAUSE-IgAN研究预计在2025年获得最终结果(24个月)。
今年6月,诺华以总额35亿美元收购Chinook Therapeutics。诺华曾在新闻稿中表示,随着成功收购Chinook Therapeutics,其肾脏产品组合扩展了另外两种正在研发的IgA肾病药物,包括选择性内皮素受体A(ETA)小分子拮抗剂atrasentan和一款皮下注射的抗APRIL单克隆抗体zigakibart(BION-1301),丰富了现有产品线。
小结
作为FDA批准的首 款口服单药治疗成人PNH的药物,iptacopan势必改变现有治疗格局。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57