在医药生产领域里,随着新设备、新技术、新科技成果陆续落地应用,已上市后药品生产过程中的变更是不可避免。2023年12月08日,笔者从上海市药品监督管理局平台查询得知,上海市药品监督管理局发布《上海市药品上市后变更备案管理工作程序和要求(试行)》。本工作程序自发布之日起实施。新规与2023年7月发布的《上海市药品上市后变更备案管理实施细则》(征求意见稿)相比,名称已发生变更。上海市药品监督管理局2021年01月发布了《关于药品上市后变更管理类别沟通交流事项的的通告》,明确了药品上市后变更管理类别沟通交流相关要求,但未发布药品上市后变更备案管理实施细则。那么本次发布药品上市后变更备案管理实施细则有哪些亮点值得关注呢?
一、已上市药品变更备案法规政策依据
近年来,中国药品上市后变更的监管制度逐渐与国际标准接轨,监管制度得到了不断的完善。为了规范药品上市后的变更行为,中国政府制定了一系列法律法规和部门规章,包括《中华人民共和国药品管理法》《中华人民共和国疫苗管理法》《药品注册管理办法》《药品生产监督管理办法》和《药品上市后变更管理办法(试行)》等。
此外,为了更好地指导持有人开展药品上市后的变更研究,中国政府还配套出台了多项指导原则,包括《已上市化学药品药学变更研究技术指导原则(试行)》《已上市中药药学变更研究技术指导原则(试行)》《已上市生物制品药学变更研究技术指导原则(试行)》和《已上市化学药品和生物制品临床变更技术指导原则》等。这些指导原则旨在确保药品上市后的变更研究科学、规范、可行,并且符合中国药品监管法律法规的要求。
通过这些法律法规、部门规章和指导原则的实施,中国药品监管部门可以更好地对药品上市后的变更进行监管,保障公众用药安全和有效。
二、新规适用于哪些药品上市后变更?
2021年1月13日发布实施的《药品上市后变更管理办法(试行)》是我国首部专门针对药品上市后变更设置的规范性文件,进一步明确了备案类变更的基本程序,并要求省级药监部门对备案变更管理工作制定具体程序,《上海市药品上市后变更备案管理工作程序和要求(试行)》对备案类变更的适用范围进行了明确。

三、新规对上市后药品变更备案办理流程影响几何?
那么上海局发布《上海市药品上市后变更备案管理工作程序和要求(试行)》的备案类变更的工作程序是什么?是否对现有备查流程有影响?作为变更控制管理人员,需要密切关注这一新的工作程序和要求,及时了解和掌握相关法规和指导原则的最新动态,以确保药品上市后的变更管理符合法规要求,保障公众用药的安全性和有效性。同时,持有人也需要加强与上海局的沟通和合作,积极配合相关审评和核查工作,确保药品上市后的变更备案顺利进行,笔者按照办理流程关键节点进行梳理分析。
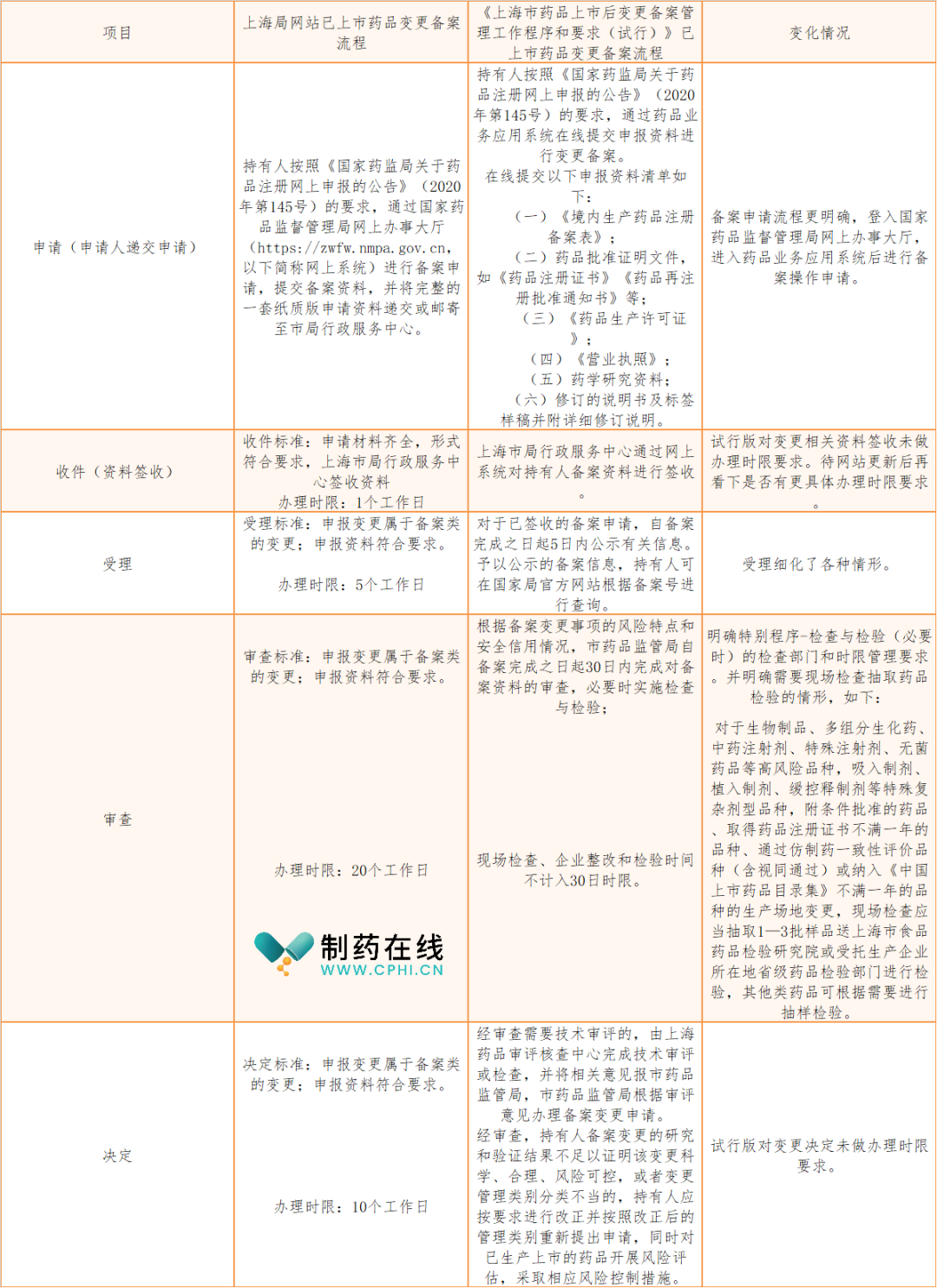
上海市已上市药品变更备案流程变化对照表
参考文献
[1] 上海市药品监督管理局官网、中国食品药品监管等
作者简介
滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57