12月15日,FDA宣布完全批准由安斯泰来和辉瑞旗下Seagen所开发的抗体偶联药物(ADC)Padcev(Enfortumab vedotin)与默沙东PD-1抑制剂Keytruda(Pembrolizumab)构成的联合疗法,用于一线治疗局部晚期或转移性尿路上皮癌(la/mUC)成人患者。
01
进击中的重磅ADC
单药&联合治疗“两把抓”
Enfortumab vedotin是由安斯泰来(Astellas)开发的连接蛋白-4(Nectin-4)抗体偶联药物(ADC)。2019年,美国食品药品监督管理局(FDA)基于关键单臂临床II期研究(EV-201)授予其加速批准上市,用于治疗接受过PD-1/L1抑制剂和含铂化疗或不适合含顺铂化疗且经过至少一线治疗的局部晚期或转移性尿路上皮癌[1]。此后,基于验证性临床III期(EV-301)研究结果,其单药治疗在多国陆续获批上市(图1)。2023年,该药已在中国递交上市申请,预计2024年获批上市。
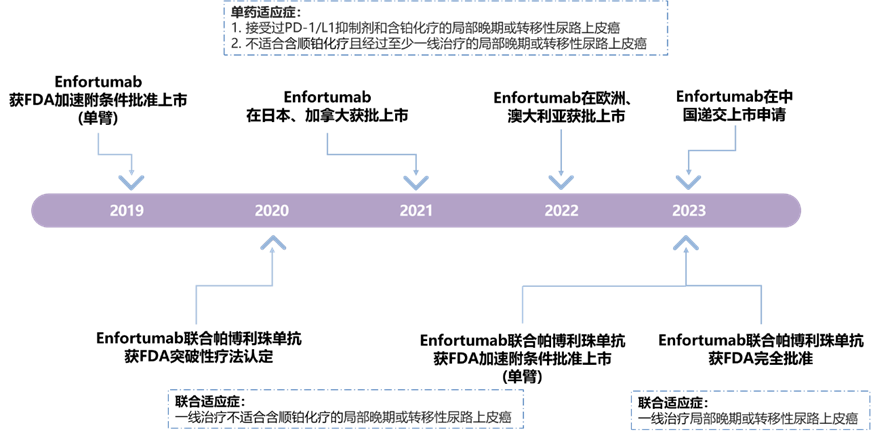
图1. Enfortumab vedotin注册时间线
除单药治疗外,安斯泰来在Enfortumab与PD-1抗体“K药”帕博利珠单抗联合治疗方面也进行了积极探索,并获得相当优异的成果:
据FDA官网报道,2023年4月20日,FDA基于单臂临床Ib/II期研究(EV-103)加速批准联合治疗,用于不适合含顺铂化疗的局部晚期或转移性尿路上皮癌的一线治疗。
2023年12月15日,联合治疗因验证临床研究(EV-302)突出结果获FDA完全批准,用于一线治疗局部晚期或转移性尿路上皮癌。此次获批主要是基于在EV-302/KN-A39临床III期试验中所评估的疗效结果,这是一项在886例既往未接受过全身性治疗的la/mUC患者中开展的开放标签、随机化试验。患者以1:1的比例随机接受含铂化疗(吉西他滨联合顺铂或卡铂)或Padcev联合Keytruda组合。主要疗效结局指标为设盲独立中心审评所分析的总生存期(OS)和无进展生存期(PFS)。
此次获批相较于PDUFA日期提前了近5个月,这可谓真是一路高歌,喜讯不断。
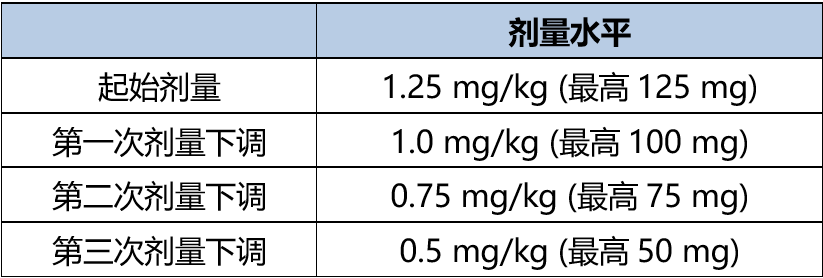
Enfortumab vedotin商品名为Padcev,单药和联合治疗推荐剂量均为1.25 mg/kg(最大剂量125 mg),分别在一个周期(28天)的第1天、第8天和第15天进行静脉输注,直至疾病进展或发生不可接受的毒性。在剂量调整方面,Enfortumab至多有三次剂量调整的机会,从1.25 mg/kg可降至1.0 mg/kg、0.75 mg/kg和0.5 mg/kg(表1)。值得注意的是,该药存在严重皮肤不良反应的黑框警告。此外,同时使用P-gp和强CYP3A4抑制剂,可能增加Enfortumab暴露量。
表1. Enfortumab剂量调整表
02
Enfortumab组成及作用机制
Enfortumab由三部分组成,分别为全人源抗Nectin-4 IgG1 kappa单克隆抗体、蛋白酶可裂解马来酰亚胺酰卡缬氨酸-瓜氨酸连接链和小分子微管破坏剂单甲基奥瑞他汀E(MMAE),药物抗体比约为3.8:1。Enfortumab与表达Nectin-4细胞结合,形成的ADC-Nectin-4复合物内化并通过蛋白酶释放微管破坏剂MMAE,从而破坏细胞内的微管网络,诱导细胞周期停滞和凋亡[2]。
![Enfortumab vedotin作用机制[2]](https://cimg.cphi.cn/img_Cphi_cn/news/2023_12/Mimg_2312210111571514.png)
图2. Enfortumab vedotin作用机制[2]
03
Enfortumab临床研究盘点
数据优异
单药治疗:EV-201
EV-201(NCT03219333)是一项全球单臂临床II期研究,分为两个队列。其中,队列1用于评估在经抗PD-1/L1治疗和含铂化疗的局部晚期或转移性尿路上皮癌人群中的疗效,队列2人群为经PD-1/L1抑制剂治疗,不适合顺铂且未经铂治疗的晚期尿路上皮癌。主要终点为经BICR评估的ORR,次要终点为持续应答时间、PFS、OS、安全性和耐受性。
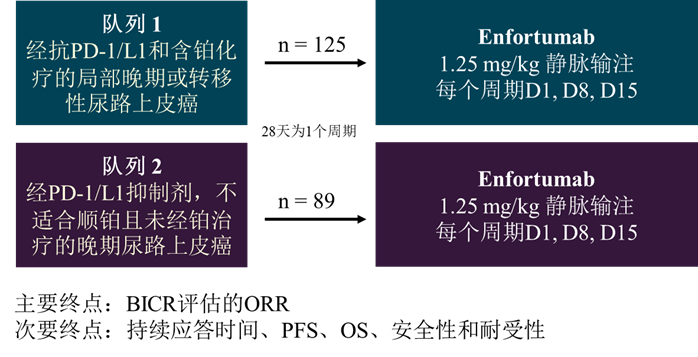
图3. EV-201研究设计
截至2019年3月1日,队列1共入组128例受试者,其中125例接受治疗[3]。中位治疗时间为4.6个月,经BICR确认的ORR为44%(95% CI, 35.1-53.2),中位持续应答时间为7.6个月(95% CI, 6.3-NE),中位PFS和OS分别为5.8个月(95% CI, 4.93-7.46)和11.7个月(95% CI, 9.10-NA)。
截至2020年9月8日,队列2共纳入了91例患者,其中89例接受了治疗[4]。经BICR确认的ORR为52%(95%CI, 40.8-62.4),中位PFS为5.8个月(95%CI, 5.0-8.3),中位OS为14.7个月(95%CI, 10.5-18.2)。
单药治疗:EV-301
EV-301 (NCT03474107)是一项开放标签、随机、多中心临床III期研究,也是EV-201队列1的验证性临床研究。受试者按1:1随机分配至Enfortumab试验组和研究者选择的化疗(多西他赛、紫杉醇或长春氟宁)。主要终点为OS,次要终点为研究者评估的PFS、ORR和安全性。
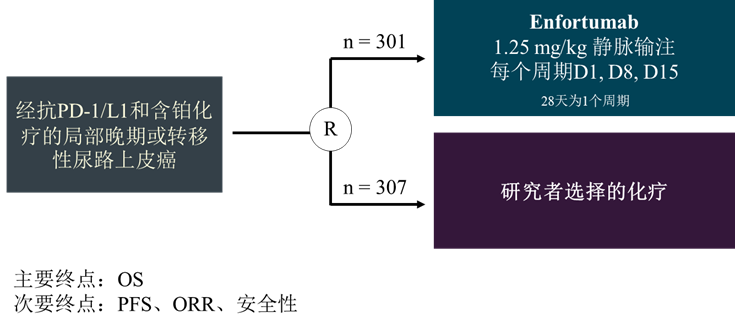
图4. EV-301研究设计
截至2020年7月15日,共计608例受试者随机入组[5],试验组和化疗组中位OS分别为12.88个月和8.97个月(HR 0.70; 95% CI, 0.56-0.89; p=0.001),中位PFS为5.55 vs 3.71个月(HR 0.63; 95% CI, 0.51-0.75; p<0.001)。此外,其在2021年ASCO会议中更新了OS数据[6]。截至2021年7月30日,中位OS: 12.91 vs 8.94个月(HR 0.704; CI, 0.581-0.852; P=0.00015)。相较于化疗组,Enfortumab显著延长OS 3.97个月。
联合治疗:EV-103
EV-103(NCT03288545)是一项多队列临床Ib/II期研究,用于评估单药和联合帕博利珠单抗在晚期尿路上皮癌治疗中的疗效和安全性。FDA基于剂量递增、队列A和队列K数据,加速批准联合疗法。
截至2019年10月8日,剂量递增和队列A共纳入45例未经治疗不适合顺铂治疗的受试者[7],研究者确认的ORR为73.3%(95%CI, 58.1-85.4),中位PFS为12.3个月(95% CI, 7.98-NA)。截至2023年2月,队列K共有149例受试者接受治疗[8],其中联合组76例,单药组为73例。联合组和单药组ORR分为64.5%(95% CI, 52.7-75.1)和45.2%(95%CI, 41.74-65.61),联合组中位PFS和OS均未达到,单药组中位PFS和OS分别为8.2和21.7个月。
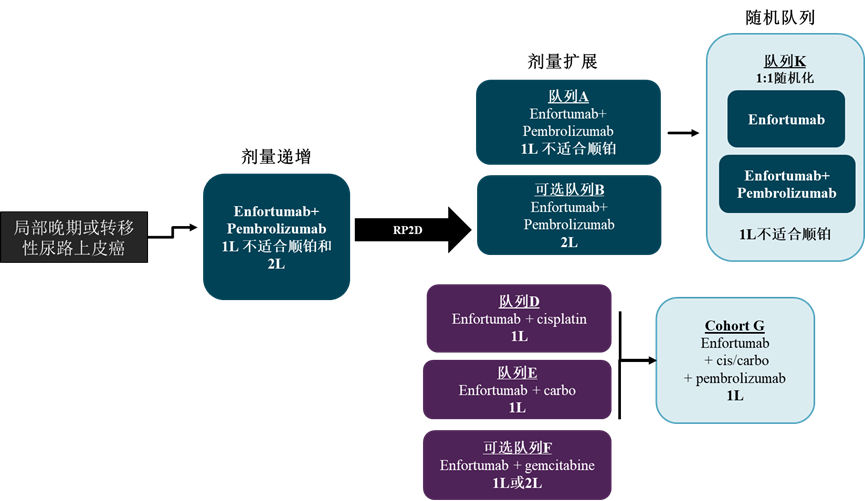
图5. EV-103研究设计
联合治疗:EV-302
本次联合疗法的获批就是基于EV-302(NCT04223856)研究,它是一项开放标签、随机对照的临床III期研究,以尿路上皮癌一线标准化疗为对照(吉西他滨+顺铂/卡铂),用于评估未经治疗的局部晚期或转移性尿路上皮癌。主要终点为BICR评估的PFS和OS双终点。值得一提的是,该项研究不论适合或不适合顺铂治疗的人群均可纳入,可见EV-302研究拓展了EV-103研究人群。

图6. EV-302研究设计
默沙东在2023 ESMO会议上报告了EV-302研究的最新进展[9],相较于化疗,Enfortumab联合帕博利珠单抗显著延长中位OS 15个月以上,中位OS分别为31.5 vs 16.1个月(HR 0.47; 95% CI, 0.38-0.58; P<0.00001),中位PFS为12.5 vs 6.3个月(HR 0.45; 95% CI, 0.38-0.54; P<0.00001)。
04
与多款药物探索联合治疗
Enfortumab多点突破 未来可期
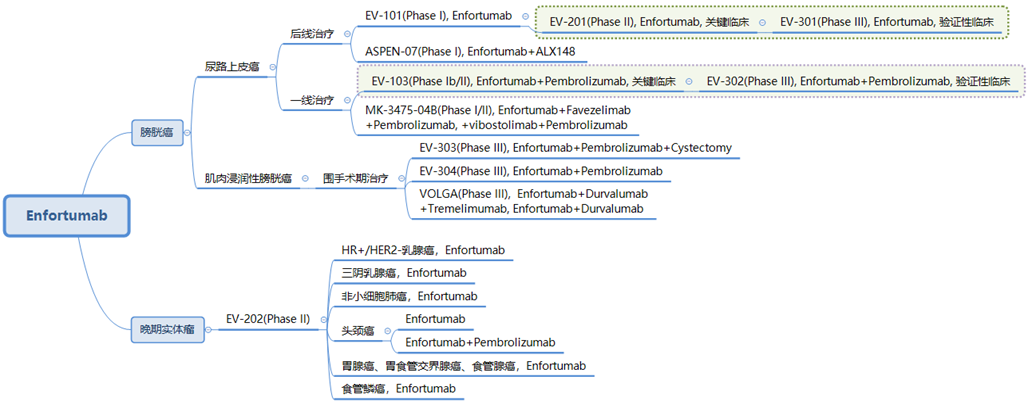
图7. Enfortumab vedotin开展的临床研究
根据上图汇总的临床信息[10],我们可以看到其联合治疗逐渐往更前线布局,如肌肉浸润性膀胱癌的围手术期治疗。除了与热门靶点PD-1/L1抗体联合外,Enfortumab与CD47检查点抑制剂ALX148、LAG-3抗体Favezelimab、TIGIT抗体Vibostolimab也在探索联合的可能性,且主要集中在晚期尿路上皮癌的治疗上。
同时,Enfortumab也在其他晚期实体瘤中积极开展临床研究,而其能否在其他瘤种中突破重围,药渡将带你持续关注。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57