药物的半衰期决定了它在体内的停留时间。短的半衰期可以通过给药间隔和剂量来补偿,但在成本和安全性方面存在限制。那些获得了监管批准的多肽药物,为我们提供了将肽稳定性从几分钟提高到几小时甚至更长时间的成功案例。与内源性肽相比,批准的肽治疗药物的血浆半衰期显著提高。
多肽化学使用不同的改性策略,来延长肽治疗剂的稳定性。通过使用这些化学修饰来稳定生物活性肽,缓解血液或组织蛋白酶介导的降解和失活,从而增强多肽候选药的类药性。
01
N端乙酰化
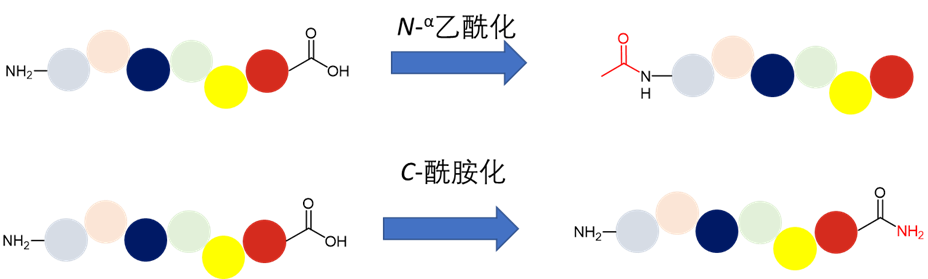
图片图1. 多肽N端乙酰化与C端酰胺化
多肽N端乙酰化是最常见的多肽化学改性增加稳定性的手段之一。值得注意的是,截至2021年底,62个(不包括已撤消的罗穆尔肽和安巴莫司汀)已上市的短肽(由小于或等于15个氨基酸残基组成)中,有37个实体在其N端通过酰化、焦谷氨酸或环化的方式得以封闭。在Nα没有封闭的多肽药物中,有11个为含二硫键的环肽和1个酰胺化环肽,还有一个为prodrug。从分析数据来看,截止2021年底FDA批准的短肽药物中,只有9种线性肽实际上具有自由Nα基团。
多肽N端封闭,除了避免外肽酶(Exopeptidase,或称“肽链端解酶”)的酶解作用之外,防止多肽以DKP (diketopiperazine,二酮哌嗪)的方式化学降解,也是一个重要的原因。拥有自由Nα基团的多肽肽链,可以在碱性至中性条件下通过DKP的方式进行降解,产生一个六元环2,5-二酮哌嗪,以及相应的缺失N-端二肽的缩短的肽链 (图2)[1]。
DKP是多肽合成、纯化、制剂和存储过程中,常见的降解类型之一。为了防止外肽酶的酶促降级,以及DKP化学降解,多肽药物尤其是较小尺寸的多肽药物,通常借助N端乙酰化封闭的方式。
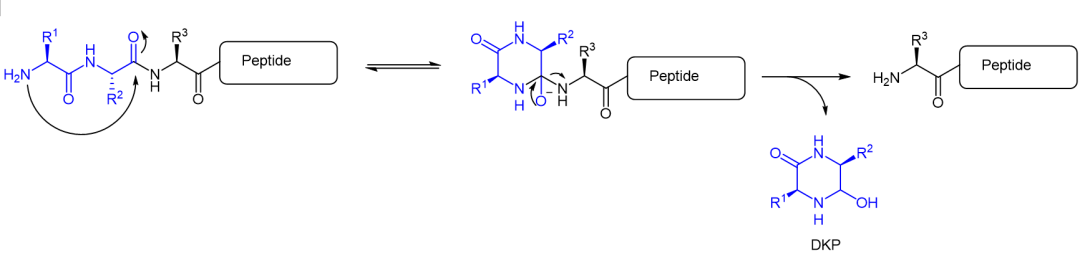
图2. 多肽DKP降解机理
类似的是,在多肽C端可以使用酰胺化,将多肽C端天然的羧酸基团转化为相应的酰胺基团,降低carboxypeptidase(羧肽酶)对于多肽C端某些特定的氨基酸的酶解(例如:羧肽酶A裂解C端的Phe、Tyr、Trp或Leu;羧肽酶B裂解C端的Lys或Arg)。若将这些C端氨基酸替换为相应的氨基酸酰胺,羧肽酶的酶解作用或将显著降低。
02
多肽环化
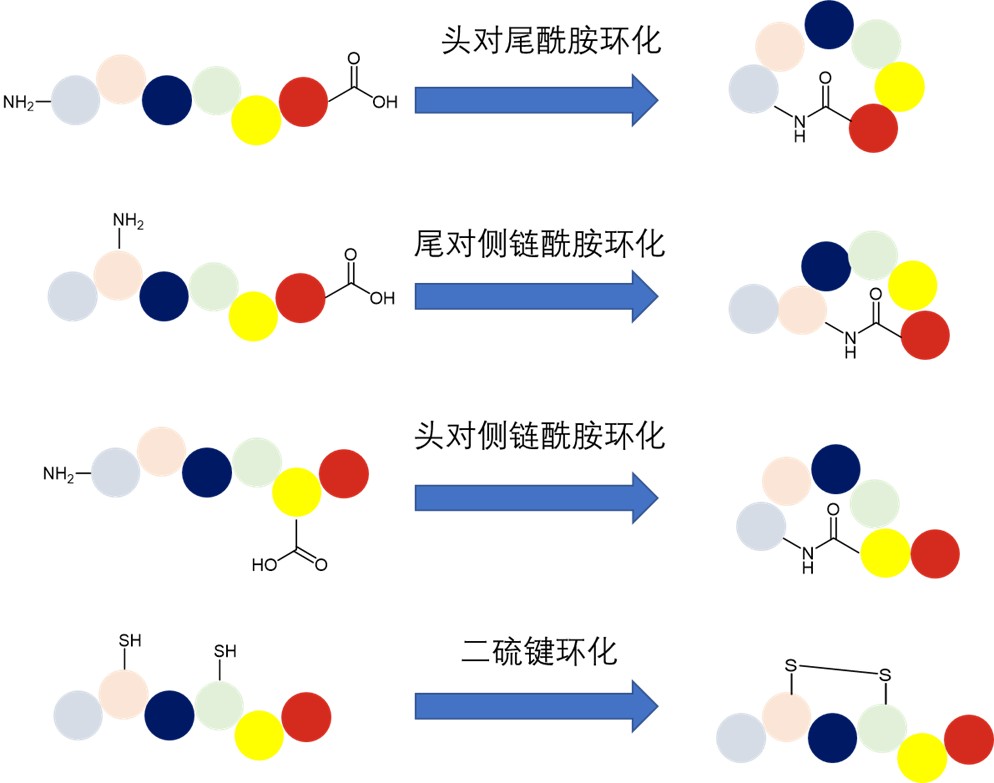
图3. 多肽环化模式示意图
多肽环化是常见的多肽改性,它不仅同时消除了多肽N端和C端易遭受外肽酶降解的氨基和羧基,而且可以将多肽的构型保持在利于与受体结合的状态,从而大大提高这些多肽的生物学活性。最新获得FDA监管批准的新药,治疗念珠菌血症和侵袭性念珠菌病的棘白菌素多肽类似物——Rezafungin(图4),就是一款环肽药物。
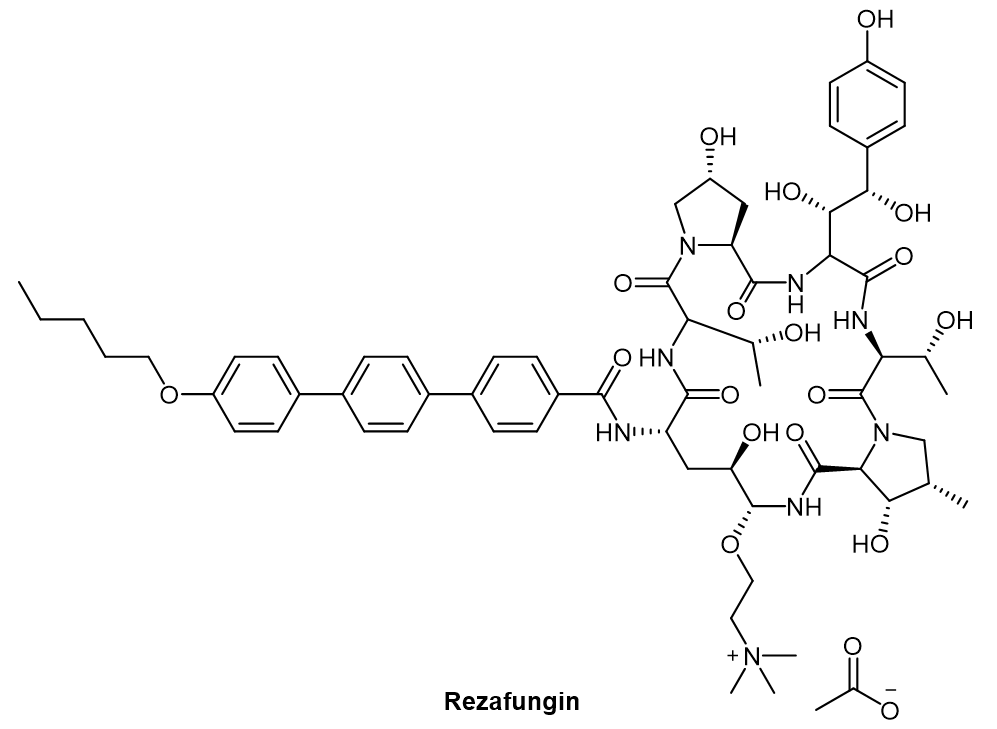
图4. Rezafungin化学结构
常见的多肽环化方式包括:
头对尾酰胺环化
头对侧链酰胺环化
尾对侧链酰胺环化
侧链对侧链酰胺环化
二硫键环化
硫醚键环化
三唑环化
乙烯键环化
03
D-氨基酸替换
D-氨基酸替换也是一种常见的增加多肽药物稳定性的手段,可以降低空间构象依赖的酶水解。由于核糖体对L-氨基酸具有特异性,因此D-肽很少天然存在于生物体中,不易被消化或降解。D肽模拟肽是设计用于模拟通常具有治疗特性的天然L肽的D肽。D-氨基酸多肽尤其在多肽抗生素的开发过程中,发挥着重要的作用[2]。
04
N-甲基化多肽
N-甲基化多肽,不仅可以增加多肽的化学稳定性,降低内肽酶的酶促降解,而且对于多肽的空间结构也产生极为关键的作用。通过N-甲基化,受影响的酰胺键不再成为H-键供体,这将对多肽的二级结构影响深远。N-甲基化也因此成为即Alanine scan, D-amino acid scan之后,最常为药物化学家使用的多肽筛选工具。
著名的N-甲基化多肽上市药物,包括环孢素cyclosporine A(图5)等,其结构中包含7个N-甲基氨基酸,不仅大大提高了环孢素的水解稳定性,也为它的空间结构形成了几乎无法复制的精妙调节,使得环孢素成为第一款实现口服递送的多肽药物。
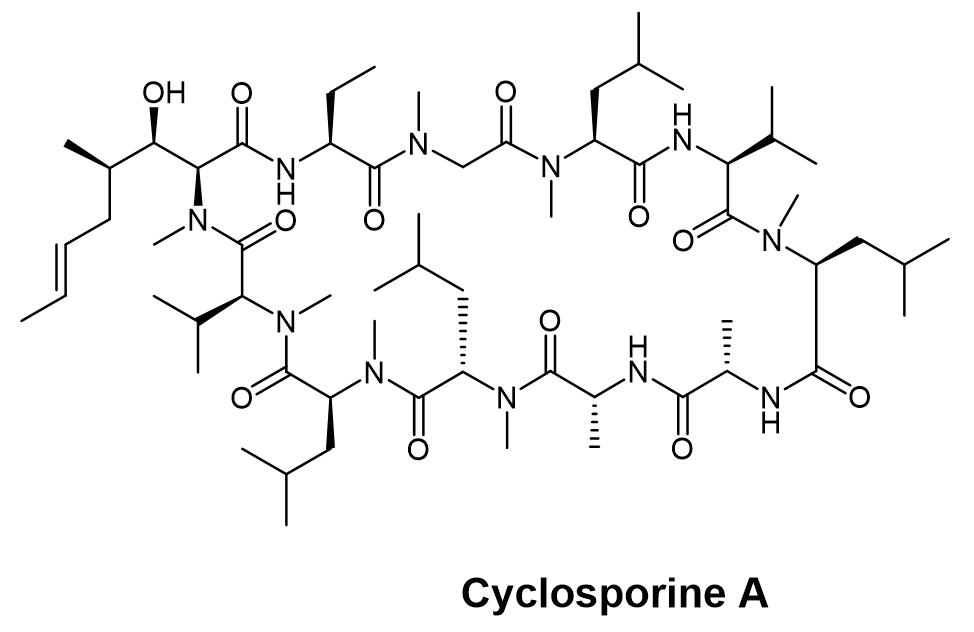
图5. Cyclosporine A化学结构
05
脂化修饰
脂化修饰(lipidation)通常可以减少一个多肽的正电荷(被修饰的氨基酸通常是赖氨酸)。但更关键的是,引入的脂质结构大大增加了多肽的半衰期,这通常被认为是通过增加与白蛋白(albumin)的结合而实现的。
在这方面最著名的例子来自于GLP-1多肽类似物,治疗2型糖尿病和肥胖症的司美格鲁肽,以及同为2型糖尿病多肽药物的GLP-1/GIP受体双重激动剂替尔泊肽(图6)。司美格鲁肽更是在使用渗透增强剂(permeation enhancer)SNAC的基础上,实现了口服制剂(Rybelsus?)的开发与上市。
关于脂化修饰这块内容,哥哈骎老师之前的文章中也有详细阐述,文章传送门:“当红炸子鸡”司美格鲁肽、替尔泊肽的背后,脂质化修饰助力多肽药物口服递送。
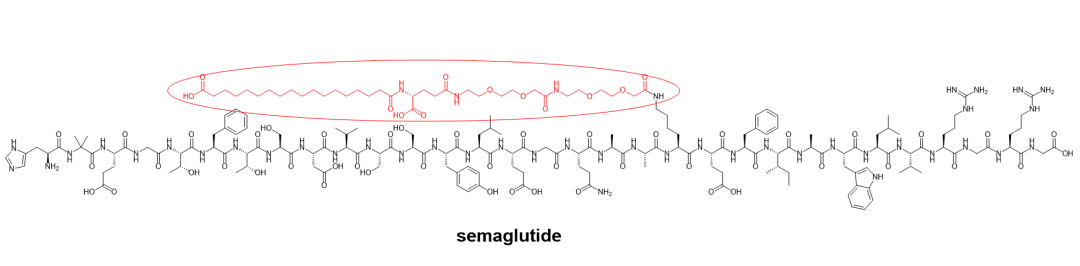
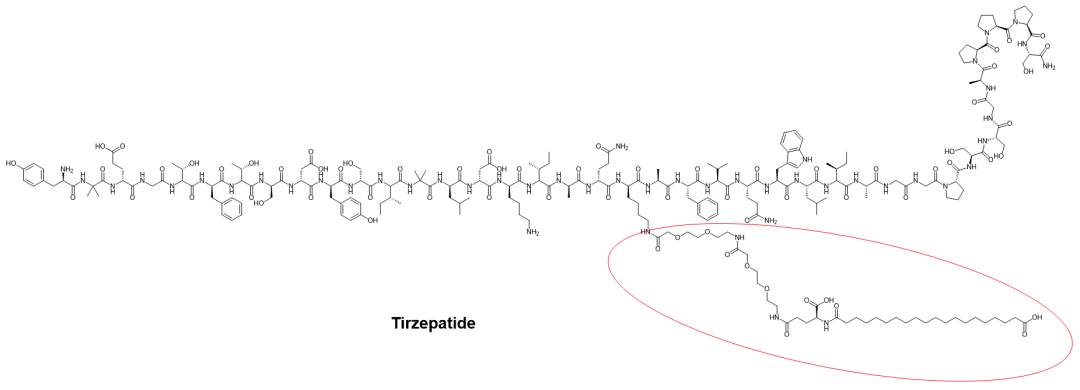
图6. 脂化多肽司美格鲁肽与替尔泊肽化学结构
06
细胞递送多肽
虽然绝大多数多肽靶向细胞外蛋白,但为了到达细胞内目标受体,多肽需要穿过细胞膜。然而,肽通常只能有限地穿越这种生物屏障。为了定制用于细胞内递送的肽,与细胞穿透肽(CPPs, Cell-Penetrating Peptides)序列的缀合,使得将生物活性肽递送至细胞内靶标成为了可能。研究中使用了几种细胞穿透肽,例如penetratin、聚精氨酸、转运蛋白和TAT (trans-activator of transcription, 转录反式激活因子) 肽[3]。
07
分子接枝 (Molecular grafting)
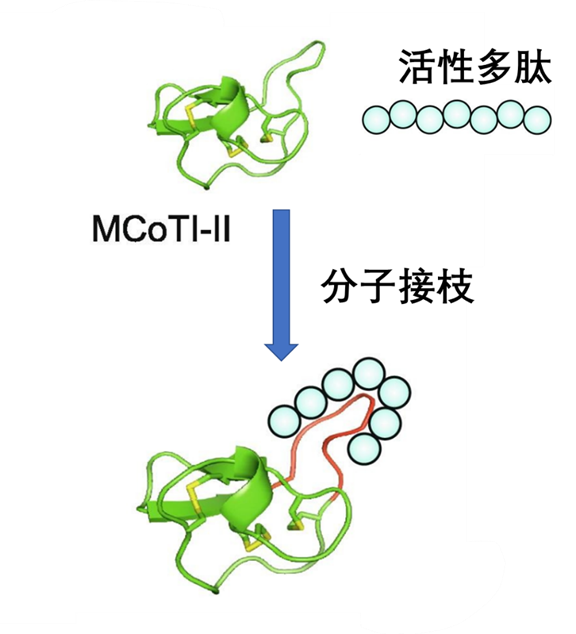
图7. 多肽分子接枝示意图,来源:Drug Discovery Today
分子接枝是多肽药物开发和新型探针设计的一个有前途的趋势。该方法用于设计具有类药物特性的肽疗法。构象受限和高度稳定的肽在这个策略中被用作支架,与生物活性表位“融合”,产生所谓的分子接枝[4]。在合成探针并验证其构象完整性后,根据其生物活性选择接枝肽。所得分子结合了肽支架提供的稳定性增加、以及生物活性表位提供的功能化的优点。
研发人员已针对此应用探索了几种自然衍生的肽,包括环状半胱氨酸结肽(knot peptide)[5]、套索肽(lasso peptide)[6]、环状向日葵胰蛋白酶抑制剂1[7]和θ-防御素[8]。该方法用于制备靶向GPCR、整合素、离子通道和其他细胞表面受体的新探针,包括血管内皮 生长因子受体 (VEGFR)、 酶或蛋白质-蛋白质相互作用。
线性抗血管生成肽P15,在人血清中2小时内分解。如果使用分子接枝策略,将P15序列整合到主链环化胰蛋白酶抑制肽——Momordica cochinchinensis胰蛋白酶抑制剂-II (MCoTI-II) 中,不仅显著提高P15稳定性至8h,而且改善了对人脐静脉内皮细胞细胞迁移的抑制特性[9]。
人血小板反应蛋白-1(TSP1)是血管生成的内源性抑制剂。来自血小板反应蛋白序列的生物活性七肽,通过与清道夫受体CD36相互作用抑制血管生成。然而,TSP1在人血清中会在4小时内降解。在MCoTI-II或向日葵胰蛋白酶抑制剂1支架中“嫁接”生物活性七肽,不仅显著提高了肽在24小时内的稳定性,而且还增加了其抑制人脐静脉内皮细胞细胞迁移的活性[10]。
分子接枝技术将丰富多肽药物开发的可使用工具,利用这种方法有可能在未来开发出更多有价值的多肽药物。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57