美国著名经济学家曼斯菲尔德曾给出这样一条论断:如果没有专利保护,60%的新药不会被发明出来。这句话高度概括出了现在医药产业的核心,即专利保护。事实上,整个现代医药产业体系,都是建立在专利壁垒之上的。
对于当下风头正盛的PD-1/L1药物,产品专利权益更加重要。近日,又有一家MNC向BMS的O药(Opdivo,纳武利尤单抗)专利保护网低头。根据FiercePharma报道,阿斯利康已同意向BMS和小野制药(Ono Pharmaceutical)支付5.1亿美元的诉讼和解金,以解决围绕其PD-L1抑制剂Imfinzi(度伐利尤单抗)和CTLA-4单抗Imjudo(替西木单抗)的所有专利纠纷。

图1. 关于上述纷争的报道,来源:FiercePharma
PART.
01
O药和阿斯利康的专利纷争
BMS/小野制药的Opdivo是一款靶向PD-1的单克隆抗体,它通过抑制PD-1免疫检查点蛋白介导的信号通路,增强T淋巴细胞的抗肿瘤免疫反应,从而抑制肿瘤的生长。
2014年底,Opdivo获FDA批准上市,用于晚期黑色素瘤的治疗,是全球首 个获批上市的PD-1抑制剂。Opdivo最初由美国生物技术公司Medarex和日本小野制药,在2005年开始合作研发。2009年,BMS以24亿美元的高价收购了Medarex,Opdivo的所有权也相应转移至BMS。目前,Opdivo的相关专利权由BMS和小野制药共同拥有。
事实上早在2003年,小野制药就提交了Opdivo的国际专利申请PCT/JP2003/008420。在此基础上,BMS和小野制药继续申请获得了大量其他专利,以保护抗体药物发明的不同方面,如美国专利US 8728474(简称“474专利”)、US 9073994(简称“994专利”)以及欧洲专利EP1537878(简称“878专利”)等。
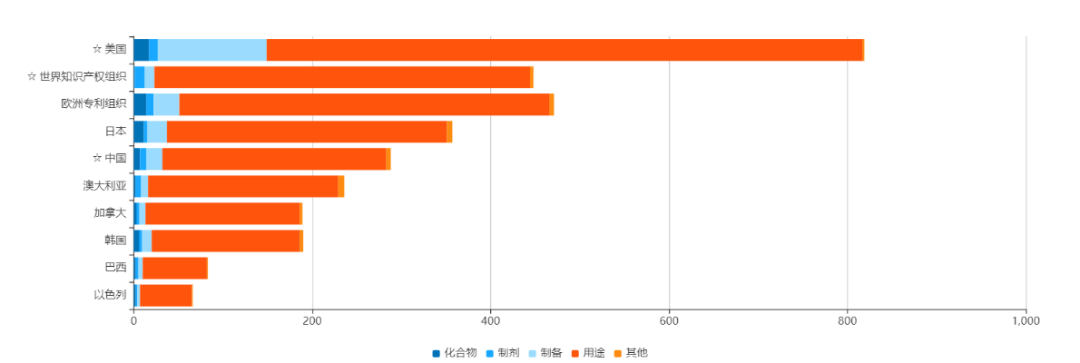
图2. Opdivo在不同国家/地区的专利及类别数量,来源:药渡数据库
2022年3月,BMS向特拉华州地方法院提起诉讼,起诉阿斯利康重磅肿瘤治疗药物Imfinzi侵犯了至少8项与Opdivo相关的专利权。BMS在起诉状中写道:“阿斯利康利用原告发明专利,研发并销售一种治疗癌症、增强免疫反应的抗PD-L1抗体产品Imfinzi(德瓦鲁单抗,durvalumab)。阿斯利康此举侵犯了原告的知识产权。”
2023年1月,在Imjudo上市3个月后,BMS就该药侵犯自家CTLA-4抗体Yervoy(伊匹木单抗)以及Yervoy与O药联合治疗的两项专利,再次向阿斯利康提出诉讼。今年4月,又在另一项诉讼中,再一次增加了另一项O药的专利侵权。
阿斯利康的Imfinzi于2017年5月获批上市,用于治疗局部晚期或转移性尿路上皮癌。目前,已在美国斩获5项单药适应症:尿路上皮癌、小细胞肺癌(SCLC)、胆道癌、非小细胞肺癌(NSCLC)。为了在PD-1血海中突围,阿斯利康采取了Imfinzi和Imjudo联合治疗方案,以期获得差异化优势。目前,Imfinzi+Imjudo方案已获FDA批准,分别用于治疗IV期(转移性)NSCLC成人患者,以及不可切除性肝细胞癌(HCC)成人患者。
今年,Imfinzi+Imjudo这一PD-1/CTLA-4联用方案,又取得了多项重要进展。在2023年美国妇科肿瘤学会(SGO)年会上,阿斯利康公布了临床II期试验KGOG3046的结果,这是一项单臂临床II期试验,旨在探讨Imfinzi和Imjudo联合化疗在晚期卵巢癌中的协同作用,主要终点是12个月的无进展生存率(PFS)。结果表明,Imfinzi和Imjudo+化疗作为新辅助治疗,在晚期卵巢癌中达到PFS终点。
在2023 ESMO上,阿斯利康报告了治疗不可切除HCC的HIMALAYA III期临床研究结果,研究包括单药治疗组、STRIDE组(Imfinzi和Imjudo联合),以及索拉非尼组。在1324例不可切除的晚期HCC患者中,经过4年随访,结果显示,STRIDE方案与索拉非尼相比,可以将死亡风险降低22%(HR为0.78;95%CI 0.67-0.92)。据估计,在接受STRIDE方案治疗的患者中,有25.2%在4年后存活,而接受索拉非尼治疗的患者为15.1%。
STRIDE方案以4年OS率25.2%,刷新了肝癌领域研究新记录。STRIDE方案也是首 个获批的抗PD-L1和抗CTLA-4抗体联合治疗晚期HCC的联合疗法。
在阿斯利康公布的2023H1财报中,Imfinzi和Imjudo销售额合计达到19.76亿美元,同比增长57%。
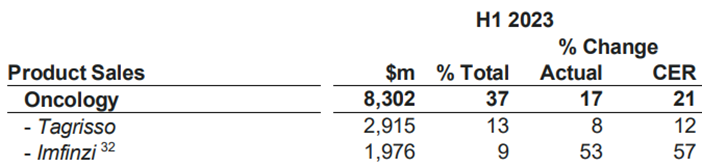
图3. Imfinzi和Imjudo销售额数据,来源:阿斯利康2023H1财报(Imfinzi32销售额包括联用的单抗Imjudo)
随着Imfinzi+Imjudo联合疗法在肝癌、卵巢癌等领域的不断突破,Imfinzi/Imjudo的市场空间未来将会被进一步打开。
也许是看到了Imfinzi+Imjudo所向披靡的未来,阿斯利康毅然斥资5.1亿美元解决了与BMS的纷争,为后续不论是单药还是联合用药撇清障碍。
这一款项于2023阿斯利康上半年财报中得到了验证,在盈亏驱动因素分析中,针对“SG&A费用”这项指标,阿斯利康表示“受到了与2023年第二季度法律和解相关的5.1亿美元费用的影响”。尽管阿斯利康并未具体说明这笔费用的去向,但市场均对此猜测可能与BMS的上述知识产权纠纷有关。

图4. 关于SG&A费用的解释,来源:阿斯利康2023H1财报
PART.
02
一招鲜,吃遍天
O药专利的躺赚之路
BMS凭借O药专利可谓是一招鲜吃遍天。在起诉阿斯利康之前,BMS和小野制药还起诉过默沙东和罗氏。
在上述我们提到的BMS和小野制药对O药申请的专利布局中,“878专利”的权利要求范围覆盖十分广泛,其于2010年9月被欧洲专利局批准生效,几乎覆盖了所有能够用于癌症治疗的人源化PD-1抗体。其他制药企业只要涉及PD-(L)1免疫抑制信号,基本都会落入“878专利”的权利保护范围。
“878专利”共有四项要求:
一是制备阻止PD-1的免疫抑制信号的抗PD-1抗体在治疗癌症药物中的应用;
二是根据权利要求一,其所述抗PD-1抗体是人抗PD-1抗体;
三是抑制PD-1免疫抑制信号的抗PD-1抗体,用于癌症治疗;
四是根据权利要求三,其所述抗PD-1抗体是人抗PD-1抗体。
为使该专利无效,2011年6月,默沙东向欧洲专利局提交了抗议,主张“878专利”所要求的权利保护范围太广,几乎涉及所有PD-1药物结构,应对该专利作无效处理。
然而2014年6月,欧洲专利局撤回了默沙东申请的专利异议,判定“878专利”有效,默沙东的PD-1单抗K药(Pembrolizumab,帕博利珠单抗,Keytruda)再次面临被“878专利”及其同族专利锚定的威胁。于是默沙东转而在欧盟的单个国家内不断进行专利挑战。
作为反击,BMS于2015年7月在美国地方法院对默沙东提出专利侵权诉讼,涉案专利为“994专利”。该专利与“878专利”属于同一个专利家族,其专利内容大致相似。“994专利”有一条关键的权利要求:一种治疗转移性黑色素瘤的方法,包括向患有转移性黑色素瘤的人静脉注射有效量的组合物,该组合物包括人或人源化抗PD-1单克隆抗体和溶液中的增溶剂,其中该组合物的施用可治疗患者的转移性黑色素瘤。
虽然“994专利”的适应症仅涉及转移性黑色素瘤以及人源化PD-1单抗,但由于“994专利”的在美母案US7595048的权利要求涉及任意人抗PD-1抗体,以及用于治疗任何过表达PD-L1或PD-L2的癌症。因此,BMS可以通过US7595048、EP1537878所要求的专利保护权利 来提起诉讼。最终BMS胜诉,与默沙东达成和解并签署和解协议。
根据协议要求,2017-2023年默沙东需根据K药的全球销售收入总额,按 6.5%的比例向BMS支付销售分成;2024-2026年,按2.5%支付销售分成。
好在K药的批准和销售未受败诉影响。K药于2014年9月获FDA批准上市,用于晚期黑色素瘤的治疗。截至今年上半年,K药在美已获批治疗18个瘤种,共计约40余个适应症。从2018年开始,K药销售额开始超过O药,2022年更是突破200亿美元大关,颇有下一代“药王”之势。
无独有偶,罗氏同样采取支付高额费用的方式与BMS进行了和解。2020年,BMS/小野制药与罗氏就后者的抗PD-L1抗体Tecentriq(阿替利珠单抗)签订了全球专利许可协议。根据协议,罗氏首先向BMS/小野制药支付了3.24亿美元的费用,并需在2026年之前每年支付全球销售净额个位数的特许权使用费。
有的药企为了避免专利纠纷,则选择与BMS达成专利许可。如2018年,BMS和再生元/赛诺菲达成关于后者PD-1抑制剂Libtayo(cemiplimab)的专利许可,条件包括:再生元/赛诺菲付给BMS 2000万美元首付款+专利许可费,2023年底之前支付给BMS/小野制药8%的Libtayo销售分成,2024-2026年间以2.5%比例上交销售分成。
PART.
03
国产PD-(L)1产品出海
专利是永远绕不过去的议题
看到这里,我们可能会有疑问,BMS/小野制药这把火怎么没烧到国内呢?这是因为我国与海外专利制度有很大差异。在美国、欧洲等国家,其专利保护的对象是PD-1靶点。而在国内,由于抗体授权标准严苛,专利则会细致到序列限定型的要求。BMS/小野制药在国内申请的专利,具体到了6条氨基酸序列。在国内开发PD-(L)1产品时,只要避开这6条氨基酸序列即可避免侵权。这也是国内PD-(L)1产品顺利大量涌现的重要原因。
然而在国产创新药陆续出海的背景下,国内药企必将难以逃避BMS/小野制药的专利网。目前,君实生物和百济神州分别完成了美国FDA对其PD-1药物的生产现场核查。君实生物的合作伙伴Coherus,已在准备特瑞普利单抗在美国商业化的相关工作。百济神州则表示,FDA正在审评对其替雷利珠单抗用于二线治疗食管鳞癌(ESCC)的上市申请,预计将在2023年取得相关监管决定。恒瑞医药也在近日宣布,其卡瑞利珠单抗联合甲磺酸阿帕替尼片的生物制品许可申请(BLA),已经正式获得FDA受理。国产PD-(L)1产品出海,只差临门一脚。
根据BMS/小野制药的专利布局,O药在美国的专利到期日为2027年6月19日,在日本的专利到期日为2031年3月11日。因此,如何在O药专利到期前,跨越其保护范围,成为国内药企亟需破局的难题。
从BMS/小野制药缜密布局的专利网,我们可以看到率先研发成功的药企具备较强的先发优势,其更可能依据药物结构及用途,申请较广范围的权利保护要求,以限制后来者。对于国内创新药企来说,如何为自己将来的产品铸造专利护城河,值得学习。另外,作为后来者,在对药物优化、改进的进程中,需时刻关注赛道内既有专利的布局情况,谨慎提防陷入“专利陷阱”。
总之,整个西方创新药体系能够顺利运行,专利是最为核心关键的因素。药企想要立足美国市场,专利将是永远绕不过去的议题。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57