12月25日,中国国家药监局药品审评中心(CDE)官网公示,诺和诺德(Novo Nordisk)递交了1类新药Etavopivat的临床试验申请,并获得受理。
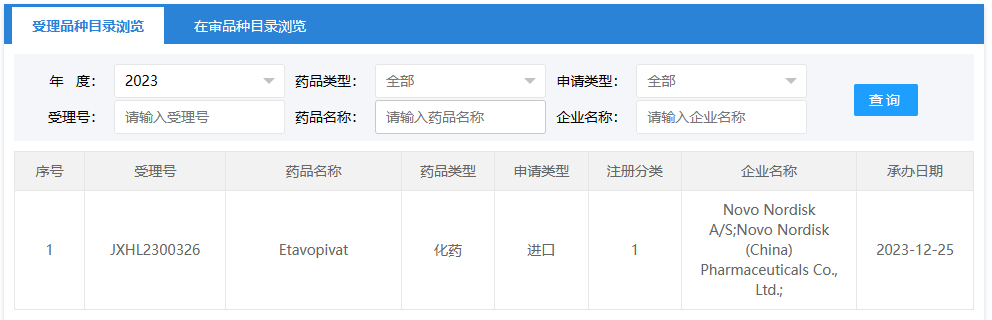
图片来源:CDE官网截图
据公开资料显示,Etavopivat是一款选择性丙酮酸激酶-R(PKR)激动剂,可通过活化红细胞内天然的PKR进而降低红细胞内无氧糖酵解产物2,3-DPG的含量,使得细胞能够携带更多氧气、增加ATP产量,并减少溶血与镰状细胞的产生,正被开发用于治疗镰状细胞贫血病(SCD)。
开拓国内市场
作为一款在研、一天一次的选择性PKR激动剂,Etavopivat可通过活化红细胞内天然的PKR进而降低红细胞内无氧糖酵解产物2,3-DPG的含量,使得细胞能够携带更多氧气、增加三磷酸腺苷(ATP)产量,并减少溶血与镰状细胞的产生,提高红细胞功能,进而改善其可变形性、膜修复能力、红细胞健康状况以及寿命。
在此前于海外开展的1期临床试验中,Etavopivat已展现良好的耐受性,并显示出具有改善红细胞健康、增加血红蛋白含量、减少病患复发性血管闭塞危象(VOC)症状与改善患者生活品质的潜力。
Etavopivat目前正于全球性Hibiscus临床2/3期试验中,检视其在SCD患者中的疗效与安全性。此外,另一项Gladiolus临床2期试验也正在进行中,用以检视此药品于输血依赖性SCD,以及另一项称之为地中海贫血症(thalassemia)的血红蛋白遗传性疾病患者中的作用。
2020年2月,该药曾获得美国FDA授予的快速通道资格、罕见儿科疾病认定与孤儿药资格,以及欧盟委员会(EC)授予的孤儿药资格认定。
此次Etavopivat在国内申报临床,或将进一步开拓国内市场,也为SCD患者提供另一药物选择。
11亿美元收购而得
强化罕见病产品组合
Etavopivat原本为Forma Therapeutics公司的首 发管线,2022年9月1日,诺和诺德和Forma Therapeutics宣布达成最终协议,诺和诺德以11亿美元总价收购后者,折合每股20美元,溢价高达92%。诺和诺德自此便将Etavopivat收入囊中。
除Etavopivat外,Forma 还拥有另一条罕见病管线药物Olutasidenib。Olutasidenib是一款口服IDH1 酶抑制剂,可透过血脑屏障,开发用于治疗胶质母细胞瘤、复发/难治型急性髓系白血病、骨髓增生异常综合征和其它IDH1突变实体瘤。
诺和诺德执行副总裁兼罕见病领域负责人 Ludovic Helfgott 表示,“为给全球罕见病和重大疾病患者研发和提供变革性药物,诺和诺德已经努力了超过 40 年。通过纳入Forma 的差异化手段以解决患者未被满足的需求,我们在提升公司镰状细胞病产品管线方面又向前迈进了一步。我们有雄心打造单药和联合治疗的一流产品组合,以解决镰状细胞病的并发症和致病的根本病因。”



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57