2001年,雷蒙德·J·德赫斯教授与Crews教授一起提出了PROTAC的概念。在《自然》杂志上,德赫斯教授总结了利用“媒介药物”将蛋白质配对的策略,以激活或抑制生物过程。
传统靶向药通过与靶点蛋白质结合来直接增加或减少其功能,以达到治疗效果,遵循了“一个靶点,一个药物”的原则。但现在,一类新兴的令人兴奋的药物——即“媒介药物”,它们通过将两个(或更多)小分子结合在一起,使得其中一个(效应器)可以作用于另一个(靶点),从而实现对靶点的治疗性调控。
如下图所示,一个双功能分子设计用来一端结合目标蛋白,另一端结合效应器蛋白,使两者接近,由此效应器蛋白能对目标蛋白发挥作用。不同的效应器蛋白能产生不同的生物效应;如果效应器是E3连接酶,这种双功能分子则被称为PROTAC。同理也可以使用分子胶来诱导邻接。此外,目标和效应器不仅限于蛋白,还可以是RNA、细胞器,甚至是完整的细胞。这样的生物分子设计扩大了靶向治疗的可能性,开辟了治疗多种疾病的新途径。
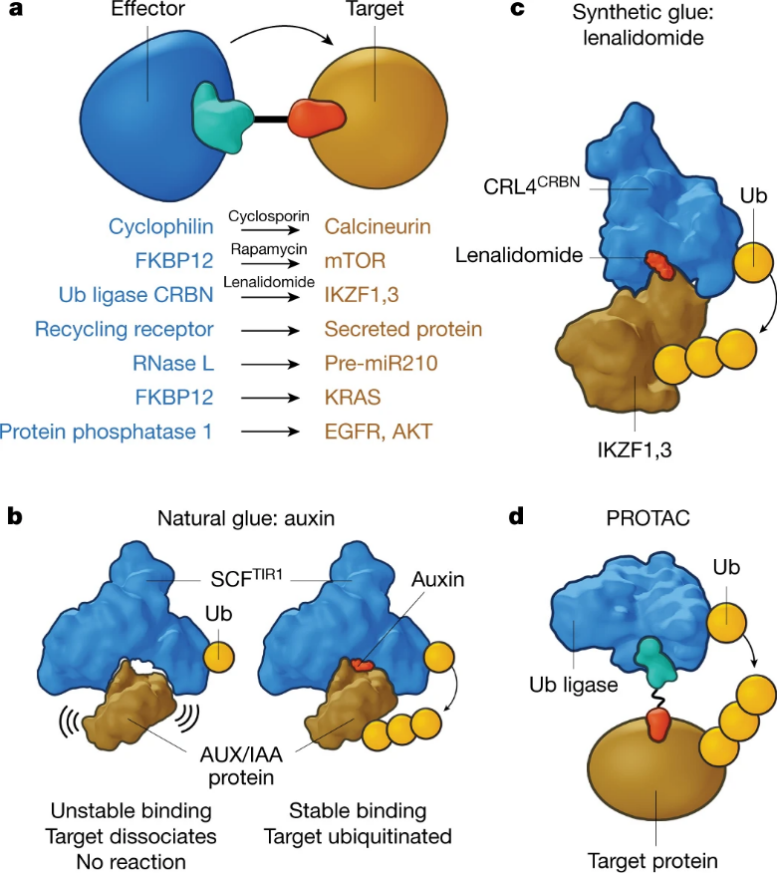
图1 双功能分子示意图,一端结合靶蛋白,一端结合effector蛋白,拉近两个蛋白,通过effector蛋白对靶蛋白产生效应。不同的effector蛋白产生不同的效应,Target与effector,也可以不限于蛋白,比如RNA、细胞器,甚至完整细胞。双功能分子包括PROTAC,分子胶等
图片来源:参考资料3
在上篇(蛋白降解剂新篇章:2023年6大创新靶点临床进展深度解析(上))中,笔者介绍了PROTAC的特点,和AR/ER降解剂、BRD降解剂、BTK降解剂NX-5948等热门降解剂的临床进展,本篇将继续介绍BRAF降解剂、SMARCA2降解剂,以及DAC(降解剂-抗体偶联物)的临床进展。
BRAF降解剂CFT1946
C4公司开发的针对突变型BRAF V600X选择性降解剂CFT1946是另一个潜力降解剂,目前实体瘤适应症正在进行2期临床研究。同样先简单解释一下为什么选择BRAF V600X作为药物靶点。
想象我们的身体是一个繁忙的城市,那么蛋白质就像是这个城市里的工人,每个都有自己的任务。在这个城市里,有一种特别的工人叫做BRAF V600,它通常帮助控制细胞的生长和分裂。但有时,这个工人会出现一些“错误”,变成一个不受控制的版本,就像一个坏了的机器,不停地工作,导致一些肿瘤的产生。这时,CFT1946就像是一个超级英雄,它的任务是找到这些出了问题的BRAF V600工人,并让它们“退休”。CFT1946特别厉害的地方在于,它不仅认得出常见的坏工人(如V600E),还能识别出一些不太常见的类型(比如G469A和G466V),甚至是那些经过特殊“剪辑”变异的BRAF。CFT1946的工作方式是通过一种叫做CRBN的机制,它能够把这些坏工人标记出来,然后让身体的清洁队伍来清理它们。这样,它帮助阻止了那些不受控制的细胞增殖,从而抑制肿瘤的生长。
用专业的表述就是CFT1946是一种口服降解剂药物,属于基于CRBN的、针对BRAF V600X突变选择性的双功能降解激活化合物(BiDAC)。这种化合物能够有效降解不同类型的BRAF突变,包括V600E(I类)、G469A(Ⅱ类)、G466V(III类)突变和p61-BRAF剪接变体。它的工作原理是通过诱导BRAF V600突变蛋白的降解,从而抑制MAPK信号通路,这是控制BRAF V600驱动的肿瘤细胞增殖和存活的关键途径。
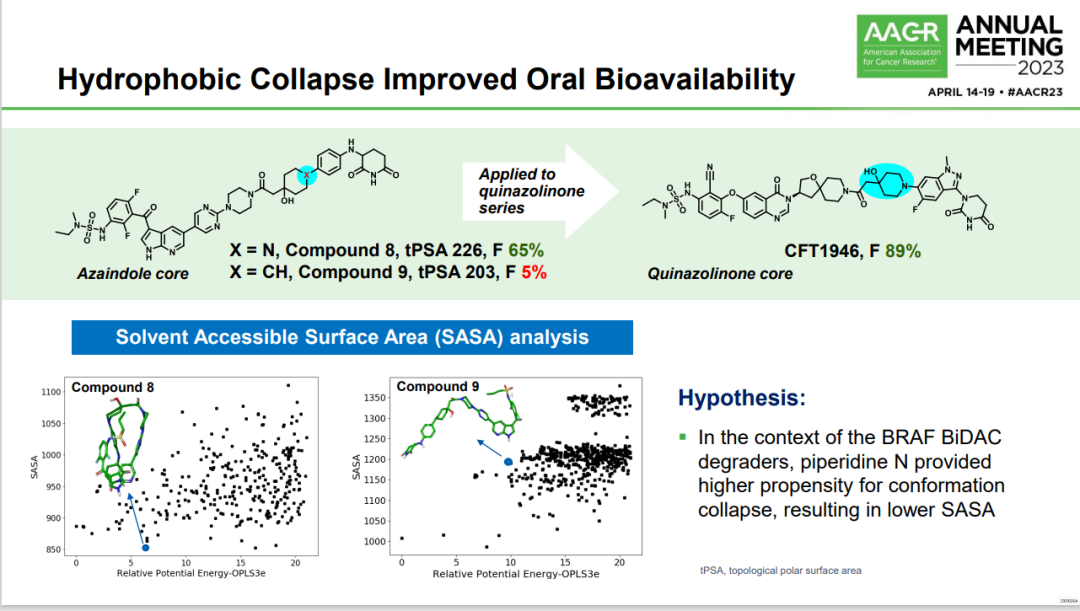
图2 CFT1946通过把一个碳替换为氮降低了SASA值从而大大提高了口服利用率
图片来源:参考资料9
根据C4公司副总裁梁博士在AACR2023年大会介绍的CFT1946药物分子设计的思路,如图所示其目标是改善口服生物利用度,改造基于将不同的化学核心应用到药物结构中。这里展示了两种不同的核心:Azaindole(化合物8)和Quinazolinone(CFT1946),以及对它们的溶剂可及表面积(SASA)进行分析的结果。
弹头使用Azaindole核心(compound 8,tPSA 226, F 65%):这种结构具有较高的极性表面积(topological polar surface area, tPSA)和较好的生物利用度(F 65%)。
弹头使用Quinazolinone核心(CFT1946,F 89%):当Azaindole核心被Quinazolinone核心取代后,生物利用度提升到89%。
SASA分析的结果揭示了一个假设:在BRAF双功能降解激活化合物(BiDAC)的背景下,piperidine N(一种化学结构,标记在CFT1946的分子结构图中的蓝色部分)提供了更高的倾向于构象坍塌,这导致了SASA的降低。简言之,这意味着药物分子更倾向于“折叠”成更紧凑的结构,从而减小其暴露于溶剂(如水)的表面积。这样的结构变化通常与更好的膜渗透性和口服生物利用度相关。
SASA分析下方的散点图展示了化合物8和化合物9在不同相对势能下的SASA值。化合物8的图表显示了一个明显的趋势,其中一些构象具有显著较低的SASA值,表明它们在空间结构上更紧凑。相比之下,化合物9的SASA值相对分散,没有表现出类似的趋势。
下图展示的是CFT1946在BRAF-V600E/NRAS-Q61K肿瘤模型中的活性,该模型是临床上已知BRAF抑制剂耐药的常用模型。
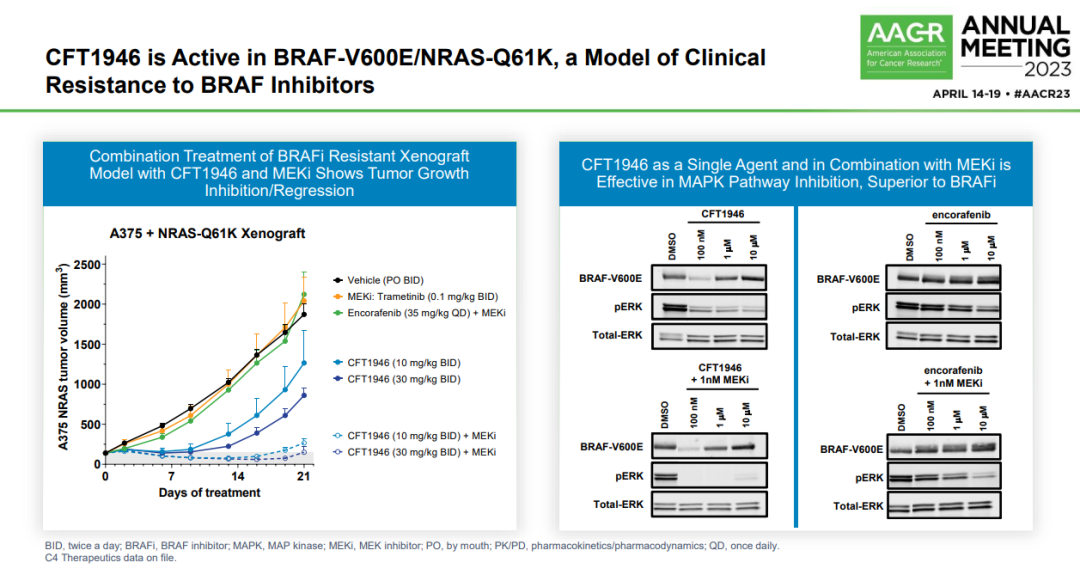
图3 CFT1946单独或与MEKi联合使用在对BRAF-V600E驱动的肿瘤模型中的活性,具有抑制MAPK信号通路和减小肿瘤体积的潜力,尤其是在对BRAF抑制剂产生耐药的情况下
图片来源:参考资料9
左侧的图表显示了与CFT1946单独或与MEKi(一种MEK抑制剂)联合治疗的A375+NRAS-Q61K异种移植模型的研究结果。不同颜色和样式的线表示不同治疗方法对肿瘤体积的影响。可以看到:
空白对照组和Trametinib(一种MEKi,0.1 mg/kg 两次/日)治疗的组,肿瘤体积增长迅速。
Encorafenib(一种BRAFi,35 mg/kg 每日一次)加MEKi的组表现出了肿瘤生长的抑制。
低剂量(10 mg/kg 两次/日)和高剂量(30 mg/kg 两次/日)的CFT1946单独治疗组显示了显著的肿瘤体积减小。
CFT1946与MEKi联合使用时,即使在低剂量下也显示了肿瘤体积的显著减少,高剂量组更好。
右侧的图表通过Western blot分析显示了CFT1946作为单一药物和与MEKi联合使用在抑制MAPK(有丝分裂原活化蛋白激酶)信号通路中的效果,这与BRAF抑制剂相比较。Western blot图像显示:
使用DMSO(对照组)时,BRAF-V600E和pERK(活化的ERK蛋白)表达正常。
CFT1946在不同浓度下能显著降低pERK水平,表明它有效地抑制了MAPK信号通路。
当CFT1946与1nM MEKi联合使用时,pERK的抑制更加显著。
Encorafenib在不同浓度下对pERK的影响较小,即使与MEKi联合使用也是如此。
目前来看,在体外和体内的BRAF V600E驱动疾病模型中,CFT1946展现出比传统抑制剂更强大的活性,能够有效降解那些对BRAF抑制剂产生耐药性的BRAF V600E/NRAS Q61K逃逸突变。
SMARCA2降解剂PRT3789
最后来讲一下Prelude therapeutics公司开发的靶向降解剂PRT3789。这是一种突破性的SMARCA2降解剂,已进入I期临床试验阶段。它主要用于治疗携带SMARCA4基因突变的癌症患者,这种突变可作为生物标志物帮助选择合适的患者群体。SMARCA2和SMARCA4是SWI/SNF复合体中的两种ATP依赖性蛋白,它们的主要功能是调节染色质结构,从而影响基因表达。这个复合体在修复DNA、细胞周期调控和细胞分化中扮演着至关重要的角色。当SMARCA4发生突变时,肿瘤细胞会依赖其旁系同源蛋白SMARCA2来维持生存,这成为一种新的药物靶向机会。因此,研究人员和药物开发商都将目光投向了SMARCA2抑制剂或降解剂,这些药物能够特异性地杀死SMARCA4突变的癌细胞。
SMARCA4基因的突变不仅在非小细胞肺癌中较为常见,而且在一些难以找到明确靶点的癌症中也经常出现,如小细胞卵巢癌、某些皮肤癌、胶质瘤和结肠癌。这意味着针对SMARCA2/4的药物可能对一系列广泛的癌症类型有效,展示了其巨大的市场潜力。
正因为如此,大型制药公司也在积极投资于这个领域。例如,礼来公司于2021年底与Foghorn Therapeutics达成了一项重大协议,针对SMARCA2选择性抑制剂的交易总金额高达16.8亿美元,这显示出业界对这一新疗法的高度期待和信心。在2022年的AACR会议上,Foghorn公布了他们首 个进入临床试验的SMARCA2/SMARCA4双抑制剂FHD-286的临床前数据,这进一步加深了这一领域的研究和发展热度。
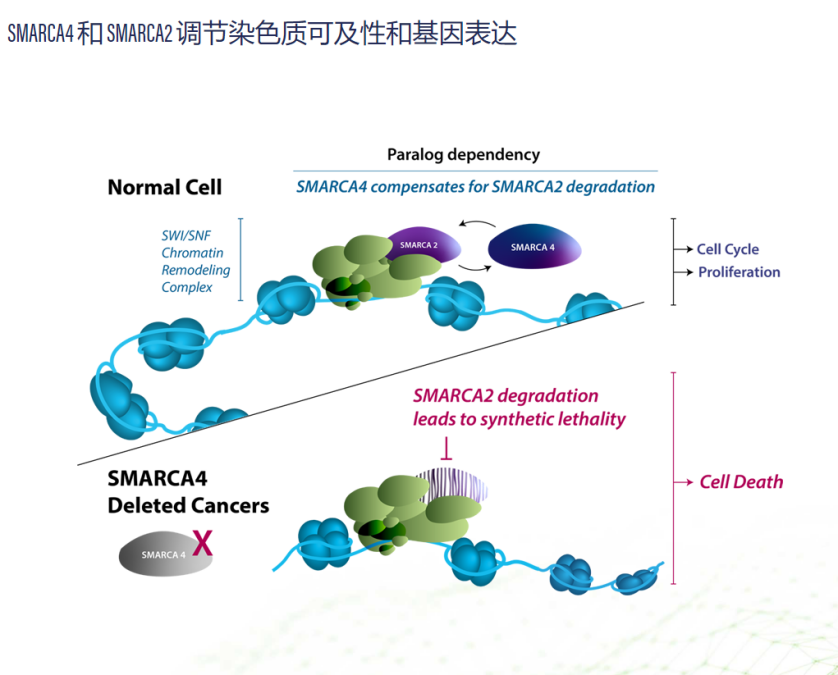
图4 选择性 SMARCA2 降解剂的机理
图片来源:Prelude公司官网
而Prelude公司副总裁朴博士在笔者研究所的报告中介绍了为什么他们选择SMARCA这个靶点。想象一下我们的细胞就像一个非常忙碌的图书馆,其中的每本书(基因)都需要被放在正确的架子上,以便读者(细胞的机器)可以在需要时找到它们。在这个图书馆中,SMARCA4就像是一个图书管理员,负责确保这些书正确地上架。但当SMARCA4出了问题,比如发生了突变,这个图书馆就会变得混乱,书籍(基因)不在它们应该在的地方,读者(细胞的机器)就会混淆,最终导致一些严重的问题,比如癌症。
PRT3789就像是被召唤来的超级图书管理员,它有一个特别的能力:找到并解决由于SMARCA4突变而导致的图书错位问题。它做的不仅仅是重新排列错放的书籍,它实际上能够找到图书馆里另一个管理员——SMARCA2,这个管理员在没有SMARCA4的情况下通常会变得不那么有效。PRT3789确保SMARCA2得到正确的指导,以便图书馆能够恢复秩序。
目前,PRT3789正在经历临床1期试验。在这个阶段,研究人员正在密切观察这个新超级管理员在现实世界中的表现,确保它既安全又有效。如果一切顺利,Prelude Therapeutics公司希望在2024年向世界展示PRT3789能够清理混乱图书馆的证据,并计划进行更大规模的试验(II/III期临床试验),这些试验将决定PRT3789是否能成为正式的图书馆救星,也就是一个批准上市的癌症治疗降解剂药物。
PRT3789作为SMARCA2的降解剂,展示了在细胞水平上对SMARCA2相比SMARCA4具有超过1000倍的选择性,这意味着它能够非常精确地瞄准并降解SMARCA2蛋白,同时基本不影响SMARCA4。这种高度的选择性对于癌症治疗至关重要,因为它允许治疗更加针对性,减少了对健康细胞的潜在损害。
该公司计划在2024年提供临床效果的证据,并计划在证据确立后进入II/III期的注册临床试验,这些试验是药物获得监管批准前的关键步骤。SMARCA2和SMARCA4都是与染色质重塑相关的蛋白质,对维持正常基因表达和细胞功能至关重要。PRT3789通过特别设计来靶向并促进SMARCA2蛋白的降解,这对于那些因SMARCA4突变而导致的蛋白失调的癌症具有潜在治疗作用。
降解剂新模式:PROTAC+ADC
最近,在药物发现领域,有一种创新的治疗策略正在浮现,它结合了两种强大的技术:抗体药物偶联物(ADCs)和蛋白质降解技术。这种新型降解剂的概念,就像是给ADCs赋予了PROTAC(一种小分子降解剂)的能力,这样的组合被称为DAC(降解剂-抗体偶联物)。
AbCellera和Prelude Therapeutics公司的合作正是基于这一理念。AbCellera利用其尖端的抗体发现平台,旨在开发出新一代的治疗药物,这些药物能够精准地靶向病变细胞。而Prelude Therapeutics则擅长于设计小分子药物,如SMARCA2降解剂。当这两家公司的技术结合时,他们的第一个合作项目就诞生了:一种SMARCA降解剂-抗体偶联物。
这种新型的治疗药物是如何工作的呢?简单来说,抗体部分负责寻找并精确靶向病变细胞,就像一个有高度专业知识的导游,能够在繁忙的城市中精确找到目的地。一旦抗体找到目标细胞,它就会将绑定在它上的SMARCA降解剂“送货上门”。这个降解剂就像是一个拆迁专家,它可以拆除导致细胞变成癌细胞的部分结构。通过这种方式,抗体和降解剂的结合不仅提高了药物的精确度,还增强了其摧毁癌细胞的能力。
这项合作的宣布,标志着医药界在精准癌症治疗领域的一个重要进步。这种策略的潜力巨大,因为它可以提供一种更为直接和个性化的治疗方法,将疗效最大化,同时减少对正常细胞的损害。随着研究的深入,我们期待看到这种新型ADCs——DAC药物——在未来癌症治疗中扮演的角色。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57