2023年,美国FDA共批准55款新药上市,仅次于2018年的59款。其中新分子实体达37种,小分子居多,占比约达55%(30款)。从疾病领域来看,小分子新药多集中在肿瘤和罕见病领域,其次为免疫炎症、感染、神经系统、心血管及代谢类疾病。
综合来看,2023年FDA批准的小分子新药一大亮点在于,具有创新机制的疗法占比延续了近年来不断攀升的大趋势。本文总结了2023年具有代表性和突破性的小分子新药,以期希望通过这些小分子新药的结构、作用机制和临床数据,对未来国内的小分子药物研发有所启发。
2023年FDA批准的小分子药物一览
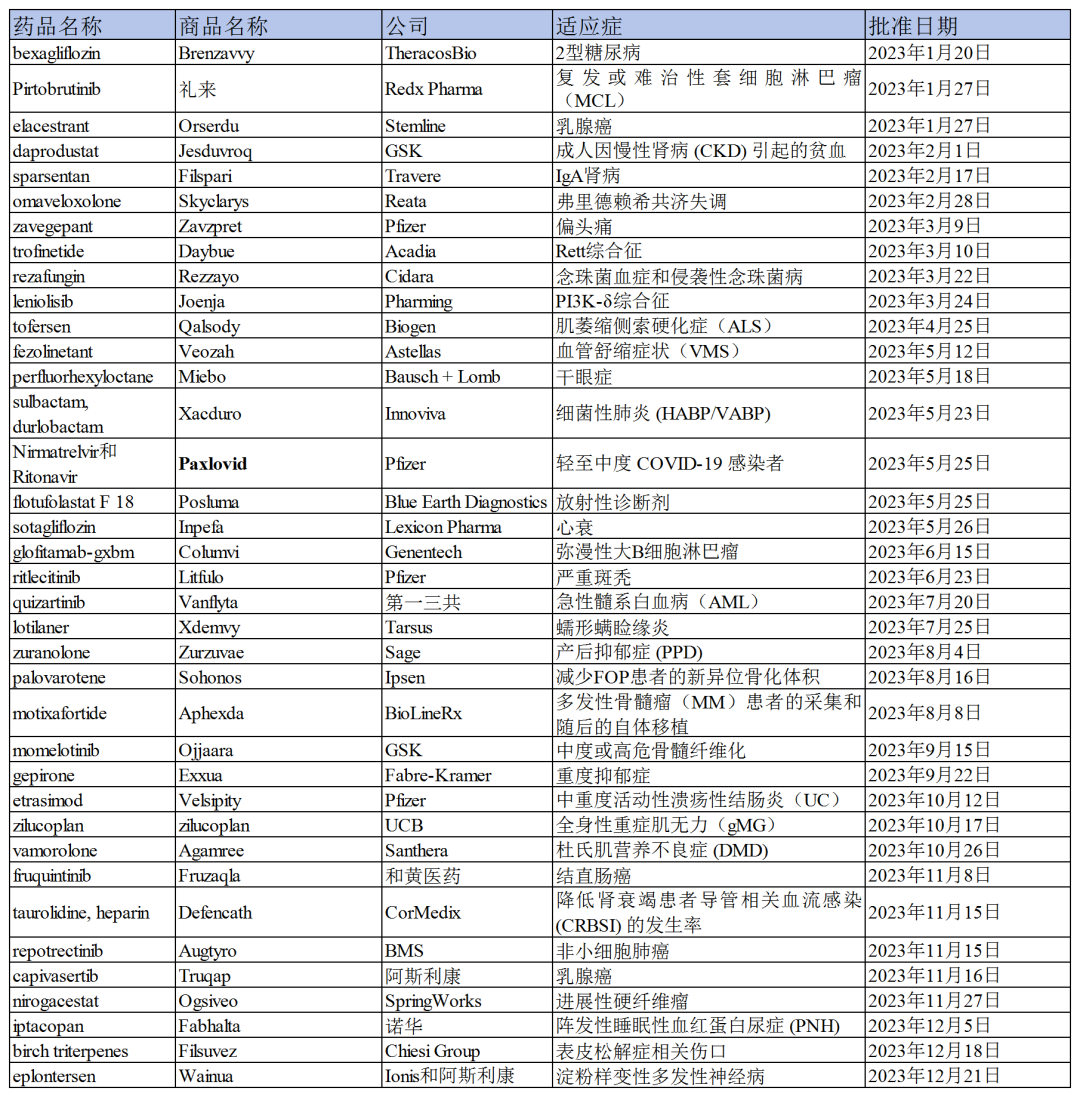
图片来源:药渡数据
FDA批准的首 款非共价BTK抑制剂
药品名称:Jayprica(Pirtobrutinib)
获批时间:2023年1月27日
适应症:复发或难治性套细胞淋巴瘤(MCL)
Pirtobrutinib目前为礼来所有,是一款非共价BTK激酶抑制剂,用于治疗至少二线全身治疗后复发或难治性套细胞淋巴瘤(MCL)的成年患者。在B细胞中,BTK信号导致B细胞增殖、运输、趋化性和粘附所必需的通路激活。Pirtobrutinib与BTK野生型和C481突变体结合,从而抑制BTK激酶活性。
临床表现:FDA的批准基于单臂的BRUIN试验中部分患者的数据:在120名MCL患者中,93%的患者接受过2次或以上治疗,所有患者均接受过一种或多种共价BTK抑制剂的既往治疗,接受Pirtobrutinib治疗的MCL患者的总体缓解率(ORR)为50%,缓解持续时间(DOR)中位数为8.3个月。
Pirtobrutinib结构式
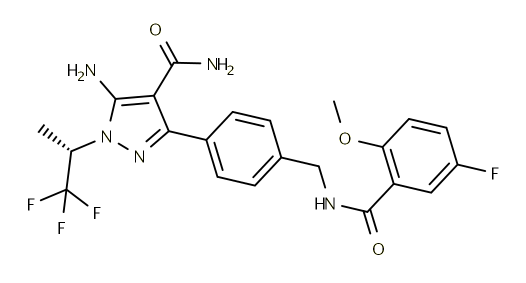
来源:药渡数据
FDA批准的首 款口服SERD
药品名称:Orserdu(Elacestrant)
获批时间:2023年1月27日
适应症:乳腺癌
Elacestrant是由Stemline Therapeutics开发的口服雌激素受体拮抗剂(SERD),用于治疗在至少一种内分泌治疗后疾病进展的,ER+/HER2-、ESR1突变的晚期或转移性乳腺癌的绝经后女性或成年男性。在ER+/HER2-乳腺癌细胞中,Elacestrant在诱导通过蛋白酶体途径介导的ERα蛋白降解的浓度下抑制17β-雌 二醇介导的细胞增殖。Elacestrant在体外和体内均表现出抗肿瘤活性,包括对氟维司群、CDK4/6抑制剂耐药的ER+/HER2-乳腺癌模型以及具有雌激素受体1基因(ESR1)突变的模型。此前,SERD只有氟维司群于2002年上市,且需要肌肉注射给药。
临床表现:FDA的批准基于在EMERALD III期临床试验的疗效:478名ER+/HER2-晚期或转移性乳腺癌的绝经后女性和男性。在228名(48%)有ESR1突变的患者中,Elacestrant组的PFS中位数为3.8个月,氟维司群或芳香酶抑制剂组为1.9个月。
Elacestrant结构式
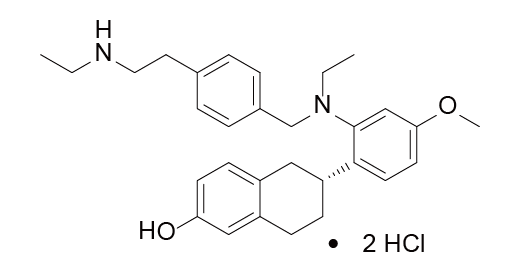
来源:药渡数据
FDA批准的首 款口服治疗慢性肾病引起的贫血药物
药品名称:Jesduvroq(Daprodustat)
获批时间:2023年2月1日
适应症:成人因慢性肾病(CKD)引起的贫血
Daprodustat是由GSK开发的口服HIF-PHI(缺氧诱导因子-脯氨酰羟化酶)抑制剂,用于每日一次治疗接受透析至少四个月的成人因慢性肾病(CKD)引起的贫血。CKD是一个日益增加的全球健康负担,影响着全世界7亿患者,据估计,1/7的CKD患者还患有贫血。抑制HIF-PHI可以稳定缺氧诱导因子,从而导致促红细胞生成素和其他参与纠正贫血的基因转录,类似于人体在高海拔地区发生的生理效应。
临床表现:FDA的批准基于ASCEND-D试验的结果:8000多名接受长达4.26年治疗的患者中,与标准护理促红细胞生成素刺激剂(ESA)相比,Daprodustat可改善和/或维持血红蛋白(Hb)在目标水平(10-11.5g/dL)内,而不会增加意向治疗(ITT)人群的主要不良心血管事件。
Daprodustat结构式
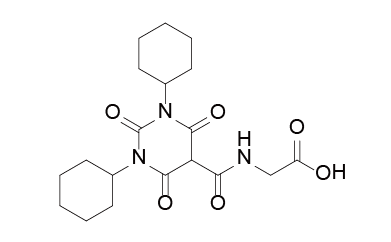
来源:药渡数据
FDA批准的首 款治疗FA的药物
药品名称:Skyclarys(Omaveloxolone)
获批时间:2023年2月28日
适应症:弗里德赖希共济失调
Omaveloxolone是由Reata Pharmaceuticals开发的first-in-class口服药物,用于每天一次治疗16岁及以上的弗里德赖希共济失调(Friedreich’s ataxia)。Friedreich’s ataxia是由编码线粒体蛋白frataxin的基因突变引起的,功能性frataxin的丧失会破坏铁硫簇的生物合成,诱导线粒体功能障碍并增加对氧化应激的敏感性。该疾病会对脊髓、周围神经和大脑造成进行性损伤,导致肌肉运动不协调、平衡不良、行走困难、言语和吞咽能力改变以及寿命缩短。Omaveloxolone的治疗机制尚不清楚,一般认为Omaveloxolone属于NRF2激活剂(五环三萜类),通过激活抗氧化转录因子NRF2起作用。
临床表现:FDA的批准基于II期MOXIe试验的结果:在第48周时,与安慰剂相比,Omaveloxolone治疗组具有统计学意义的较低mFARS评分(损伤较小),治疗差异为-2.4分。
Omaveloxolone结构式
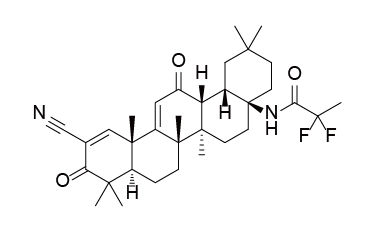
来源:药渡数据
全球首 款用于治疗Rett综合征药物
药品名称:Daybue(Trofinetide)
获批时间:2023年3月10日
适应症:Rett综合征
Trofinetide是由Acadia Pharmaceuticals公司开发的第一个用于治疗2岁及以上的Rett综合征患者的药物。Rett综合征是一种复杂、罕见的神经发育障碍,通常由MECP2基因的基因突变引起,该基因的缺陷已被证明会导致突触通讯受损,特点是在6-18个月之前有一段正常发育期,随后出现显著的发育倒退。具体表现为失去获得的沟通技巧,其它症状还可能包括出现手部刻板行为(如拧手和拍手)以及步态异常。Trofinetide是IGF -1(胰岛素样生长因子1)的氨基末端三肽(甘氨酸-脯氨酸-谷氨酸,GPE)的合成类似物,对Rett综合征患者发挥治疗作用的机制尚不清楚。
临床表现:FDA的批准基于Trofinetide在两个主要疗效终点:Rett综合症行为问卷(RSBQ)总分和临床总体印象-第12周时的改善(CGI-I)量表得分,与安慰剂相比具有统计学意义的显著改善。
Trofinetide结构式
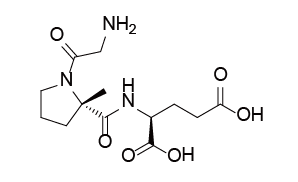
来源:药渡数据
FDA批准的首 款针对APDS的疗法
药品名称:Joenja(Leniolisib)
获批时间:2023年3月24日
适应症:PI3Kδ过度活化综合征(APDS)
Leniolisib是由Pharming开发的口服PI3K-δ(活化磷酸肌醇3-激酶-δ)激酶抑制剂,用于治疗12岁及以上患者的PI3K-δ综合征(APDS)。APDS是一种罕见的原发性免疫缺陷病,由PIK3CD或PIK3R1基因(编码PI3K-δ蛋白)中的遗传变异引起,每百万人中有1-2人患病。APDS患者会出现反复感染,尤其是鼻窦、耳朵和呼吸道,还会出现淋巴结、扁桃体和其他器官肿大,这些器官会导致气道和胃肠道阻塞。此外,APDS患者更容易患上淋巴瘤等血细胞癌。
临床表现:FDA的批准基于一项为期12周的双盲、随机、安慰剂对照研究:纳入的31名12岁及以上APDS患者中,21名患者接受了70mg的Leniolisib,10名患者接受了安慰剂,每天两次,持续12周。到研究的第85天,与安慰剂相比,服用Leniolisib的患者淋巴结大小减少,幼稚B细胞计数增加37%,这表明潜在的免疫缺陷得到了纠正。
Leniolisib结构式
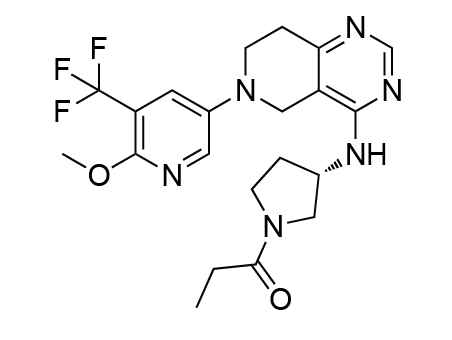
来源:药渡数据
FDA批准的首 个直接针对泪液蒸发的干眼症治疗药物
药品名称:Miebo(Perfluorohexyloctane)
获批时间:2023年5月18日
适应症:干眼症
Miebo是由Bausch+Lomb(博士伦)和Novaliq共同研发的一种半氟化烷烃,用于治疗干眼症(DED)的体征和症状,是FDA批准的第一款用于治疗干眼症的处方滴眼液。干眼症影响数百万美国人,是最常见的眼表疾病之一。Miebo旨在减少眼表泪液蒸发。全氟己基辛烷是一种半氟化烷烃,含有6个全氟化碳原子和8个氢化碳原子,可在泪膜的气液界面形成单层,减少蒸发。
临床表现:在GOBI和MOJAVE的III期关键研究中,Miebo达到了主要体征和症状疗效终点:早在第15天和第57天,患者就经历了症状缓解,在这两项研究中观察到Miebo治疗组相对于对照组(盐水)的tCFS和VAS评分都显著降低。
Perfluorohexyloctane结构式
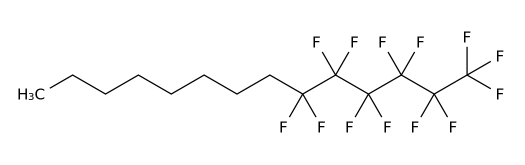
来源:药渡数据
FDA批准的首 款专门用于治疗FLT3-ITD阳性AML的FLT3抑制剂
药品名称:Vanflyta(Quizartinib)
获批时间:2023年7月20日
适应症:急性髓系白血病(AML)
Quizartinib是由第一三共开发的第二代FLT3激酶小分子抑制剂,可与标准阿糖胞苷和蒽环类药物等化疗药物联合使用,或作为化疗后的维持单药治疗,用于治疗FLT3-ITD突变的急性髓系白血病(AML)成人患者。Quizartinib及其主要活性代谢物AC886以相当的亲和力与FLT3的ATP口袋结合,两者对FLT3-ITD突变的结合亲和力比FLT3低10倍。
临床表现:QuANTUM-First是一项随机、双盲、安慰剂对照的全球III期研究,结果显示:与单独使用标准化疗相比,经Quizartinib治疗后死亡风险降低了22%,接受Quizartinib治疗的患者的CR中位持续时间延长了三倍多,为38.6个月。
Quizartinib结构式
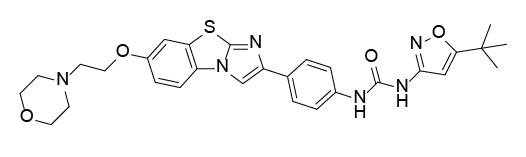
来源:药渡数据
FDA批准的首 款专门针对蠕形螨的根治疗法
药品名称:Xdemvy(Lotilaner)
获批时间:2023年7月25日
适应症:蠕形螨睑缘炎
Xdemvy是由Tarsus Pharma开发的一种外寄生虫杀剂(抗寄生虫药)滴眼液,用于治疗蠕形螨睑缘炎。Xdemvy是一种对螨虫具有高度选择性的γ-氨基丁酸(GABA)门控氯离子通道抑制剂,抑制这些GABA氯离子通道会导致目标生物体产生麻痹作用,导致其死亡。在美国,蠕形螨性睑缘炎影响着大约2500万眼科患者,这是一种常见但经常被误诊或诊断不足的眼睑疾病,由蠕形螨感染引起,蠕形螨是人体皮肤上最常见的体外寄生虫。蠕形螨性睑缘炎的特征是发红、炎症、睫毛缺失或错位、沿眼睑基部水平瘙痒。
临床表现:FDA的批准基于两项随机、多中心、双盲、空白对照研究(Saturn-1和Saturn-2)的结果,旨在评估Xdemvy在833名患者中的安全性和有效性。患有蠕形螨性睑缘炎的患者以1:1的比例随机分配到Xdemvy治疗组或对照组,并在6周内每天每只眼睛给药两次,试验结果表明Xdemvy治疗组达到了显著改善。
Lotilaner结构式
来源:药渡数据
FDA批准的首 个治疗FOP药物
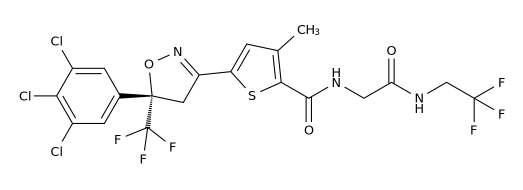
药品名称:Sohonos(Palovarotene)
获批时间:2023年8月16日
适应症:减少FOP患者的新异位骨化体积
Sohonos是由Ipsen开发的一种口服生物可利用的视黄酸受体激动剂(类维生素A),用于减少FOP(进行性骨化性纤维发育不良,俗称“石头人症”)患者的新异位骨化体积Sohonos对RAR的γ亚型具有特殊选择性,通过与RARγ结合,Sohonos抑制SMAD1/5/8的磷酸化来减少BMP/ALK2下游信号通路,从而减少ALK2/SMAD依赖性软骨形成和骨细胞分化。进行性骨化性纤维发育不良是一种罕见的常染色体显性遗传疾病,全球只有约900名患者。
临床表现:FDA的批准基于III期MOVE试验的关键疗效和安全性数据,研究结果表明,与不进行超出标准护理的治疗相比,Sohonos可有效减少年度异位骨化体积。
Palovarotene结构式
来源:药渡数据
FDA批准的首 个用于治疗MDD的口服选择性5-HT1A受体激动剂
药品名称:Exxua(Gepirone)
获批时间:2023年9月22日
适应症:重度抑郁症(MDD)
Gepirone是由Fabre-Kramer公司开发的first-in-class每日一次的口服5HT1A受体的选择性激动剂,用于治疗成人重度抑郁症(MDD)。Gepirone的抗抑郁机制被认为与其5HT1A受体选择性激动剂活性有关。
临床表现:Gepirone的批准基于两项为期8周的成人(18-69岁)随机、双盲、安慰剂对照临床试验,主要疗效指标是第8周时汉密尔顿抑郁量表(HAMD-17)总分相对于基线的变化。在这两项研究中,Gepirone治疗组的患者在主要疗效相比安慰剂组有统计上显著的改善。
Gepirone结构式
来源:药渡数据
首 创AKT抑制剂、口服选择性三磷酸腺苷(ATP)竞争性抑制剂
药品名称:Truqap(Capivasertib)
获批时间:2023年11月16日
适应症:乳腺癌
Capivasertib是由阿斯利康开发的丝氨酸/苏氨酸激酶AKT所有3种亚型(AKT1-3)的抑制剂,与氟维司群联合用于治疗患有激素受体(HR)阳性、HER2阴性、患有一种或多种PIK3CA/AKT1/PTEN改变的局部晚期或转移性乳腺癌成年患者。肿瘤中AKT激活是上游信号通路激活、AKT1突变、磷酸酶和张力蛋白同源物(PTEN)功能丧失以及磷脂酰肌醇3-激酶(PIK3CA)催化亚基α突变的结果。
临床表现:FDA的批准基于一项III期、双盲、随机试验CAPtello-291,该试验评估Capivasertib联合氟维司群与安慰剂加氟维司群治疗局部晚期HR阳性、HER2低或阴性乳腺癌。全球试验招募了708名HR阳性、HER2低或阴性乳腺癌患者,这些患者在芳香酶抑制剂治疗以及最多一线化疗期间或之后复发或进展。Capivasertib联合氟维司群与单用氟维司群相比,可将疾病进展或死亡风险降低50%,中位无进展生存期(PFS)分别为7.3个月与3.1个月。
Capivasertib结构式
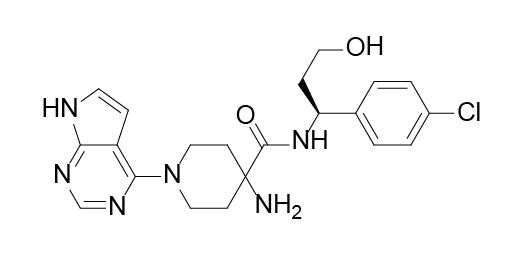
来源:药渡数据
中国药企“出海”典范
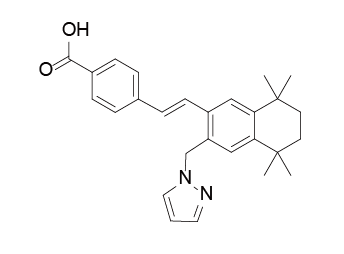
药品名称:Fruzaqla(Fruquintinib)
获批时间:2023年11月8日
适应症:结直肠癌
Fruquintinib(呋喹替尼)是由和黄医药开发的一款口服的高选择性、强效的VEGFR-1/2/3抑制剂,用于治疗既往接受过氟嘧啶、奥沙利铂和伊立替康治疗的转移性结直肠癌患者,包括既往接受过抗VEGF治疗和/或抗EGFR治疗(RAS野生型)的患者。在美国,2023年将诊断出约153000例新发结直肠癌病例,占所有新发癌症病例的7.8%。大约70%的结直肠癌患者无论是在诊断时还是治疗后都会出现转移性疾病。
临床表现:FDA的批准基于两项大型III期试验的数据FRESCO和FRESCO-2的结果,两项研究均达到了主要和关键次要疗效终点:呋喹替尼治疗组(461名)的中位OS为7.4个月,而安慰剂组(230名)为4.8个月;呋喹替尼治疗组的中位PFS为3.7个月,而安慰剂组为1.8个月;呋喹替尼组的疾病控制率(DCR)为55.5%,而安慰剂组为16.1%。
Fruquintinib结构式
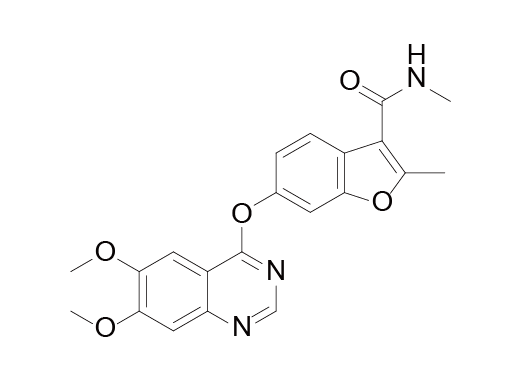
来源:药渡数据
FDA批准的首 个硬纤维瘤疗法
药品名称:Ogsiveo(Nirogacestat)
获批时间:2023年11月27日
适应症:进展性硬纤维瘤
Nirogacestat是由SpringWorks Therapeutics开发的口服γ分泌酶抑制剂,用于治疗需要全身治疗的进展性硬纤维瘤成年患者。硬纤维瘤是局部侵袭性和侵袭性软组织肿瘤,可导致严重的发病率。此外,当重要结构受到影响时,硬纤维瘤可能会危及生命。虽然硬纤维瘤不会转移,但现有的超适应症全身治疗通常难以治愈,并且手术切除后复发率高达77%。
临床表现:Nirogacestat的有效性在一项国际、多中心、随机、双盲、安慰剂对照试验中进行了评估:与安慰剂相比,Nnirogacestat治疗组的PFS具有统计显著性改善,疾病进展风险降低了71%;Nirogacestat治疗组的缓解率为41%,而安慰剂组只有8%。
Nirogacestat结构式
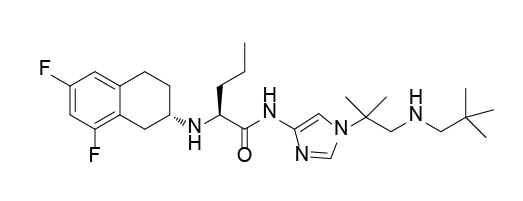
来源:药渡数据
首 款口服单药PNH疗法
药品名称:Fabhalta(Iptacopan)
获批时间:2023年12月5日
适应症:阵发性睡眠性血红蛋白尿症(PNH)
Iptacopan是由诺华研发的补体因子B抑制剂,用于治疗成人阵发性睡眠性血红蛋白尿症(PNH)。Iptacopan与补体旁路途径的因子B结合,调节C3的裂解、下游效应子的产生以及末端途径的扩增,在补体级联的替代途径中发挥近端作用,控制C3b介导的EVH和末端补体介导的IVH。PNH患者具有获得性突变,使红细胞容易被补体系统过早破坏,特点是溶血、骨髓衰竭和血栓形成,其组合和严重程度各不相同。现有的C5抑制剂治疗(以输注形式给药)可能会使PNH症状不受控制。高达88%接受抗C5治疗的患者可能患有持续性贫血,其中超过三分之一的患者每年至少需要输血一次。
临床表现:FDA的批准基于III期APPLY-PNH试验,该试验针对的是尽管先前接受过抗C5治疗但仍存在残余贫血(血红蛋白<10g/dL)的患者,这些患者转而使用Iptacopan,该试验证明在不输注RBC的情况下,该药物在改善血红蛋白方面具有显著获益,与继续接受抗C5治疗的患者相比,显著减少了输血率。
Iptacopan结构式
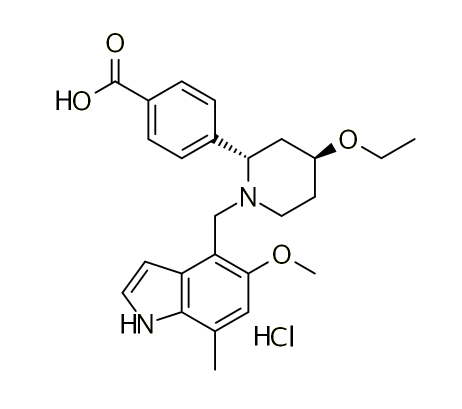
来源:药渡数据
结语
通过一览2023年FDA批准的小分子新药概况,我们发现,这些小分子新药中有相当大的比例为“first-in-class”,或是针对特定疾病的首 款疗法,或是针对特定疾病的首 款具有全新机制的疗法。这对我国医药研发领域具有较大启发意义,医药研发真正的意义并非一味地追求“ME-too”或者“Me-better”等能够快速变现的同质化产品,而是在不断追求解决人类实际疾病的过程中收获成功。在原始驱动力上,国内药企还有很多需要学习的地方。后续发展如何,药渡还将持续关注。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57