抗体偶联药物已然成为除了免疫检查点抑制剂以外,另一备受关注的领域。众所周知,抗体偶联药物主要由三部分组成,分别为靶向特异性抗原的抗体、有效载荷和连接子[1]。其中,有效载荷以小分子细胞毒药物为主。相较于单独使用小分子细胞毒药物,抗体偶联药物的优势在于其通过抗体将有效载荷递送到特定位置,进而降低对全身系统的暴露量进而提高治疗获益风险比,但同时抗体的引入也是一把双刃剑,比如增加免疫原性风险等。
此外,由于ADC复杂的组成,其药代动力学特征与常规的小分子抗肿瘤药物和单克隆抗体大有不同,这也为临床研究中剂量选择带来一定的挑战。下面,小编将从国内外指导原则出发,随后以Nectin-4
ADC Enfortumab为例,带大家了解ADC类药物的临床药理特征。
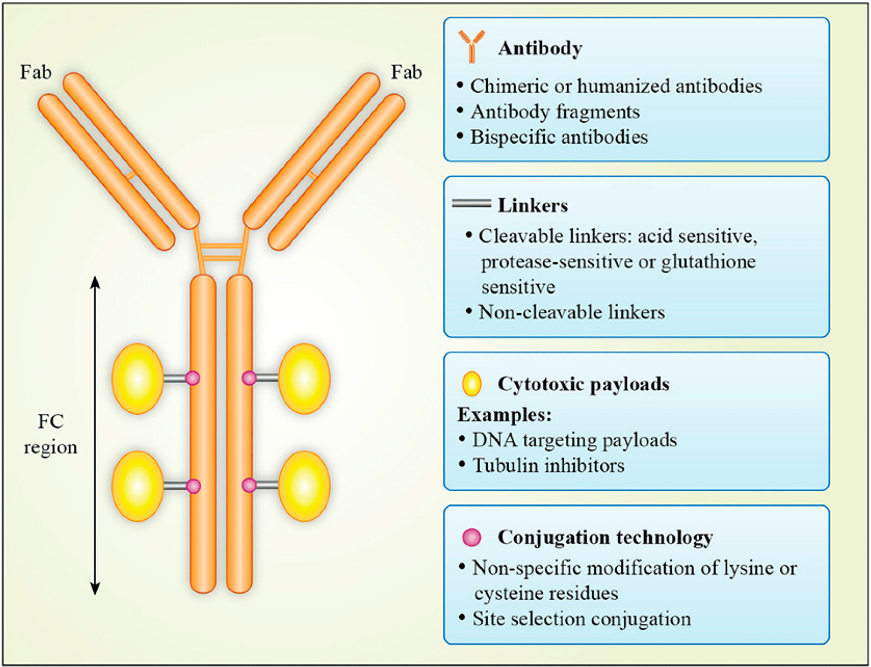
图1. 抗体偶联药物基本结构[1]
PART.
01
国内外指导原则
对抗体偶联药物临床药理规定
2023年4月,国家食品药品监督管理局颁布了《抗肿瘤抗体偶联药物临床研发技术指导原则》[2],并强调合理的给药策略是影响ADC药物获益风险特征的关键因素,需综合考虑抗体和有效载荷之间的药代动力学和药效动力学差异。此外,指导原则还指出ADC药物药代动力学研究,至少包括偶联抗体、总抗体、非偶联的小分子化合物和活性代谢产物。
2022年2月,FDA发布了《抗体偶联药物临床药理考量指导原则》草案,其主要规定了ADC药物在临床药理方面的相关内容[3],涉及生物分析方法、剂量/暴露量-效应关系、内在因素(肝肾功能损伤、体重、年龄等)、QTc评估、免疫原性和药物相互作用。另外,该草案中还阐述了在哪些情况下建议或不建议进行检测的分析物,如非偶联的小分子化合物在充分灵敏方法下未检出,FDA可能不建议检测该部分;在QTc评估时,检测非偶联小分子化合物和活性代谢产物就足够了。
PART.
02
Enfortumab药代动力学特征
Enfortumab由全人源抗Nectin-4 IgG1 kappa单克隆抗体、蛋白酶可裂解马来酰亚胺酰卡缬氨酸-瓜氨酸连接链和小分子微管破坏剂单甲基奥瑞他汀E(MMAE)三部分组成,其推荐给药剂量为1.25 mg/kg(最大剂量125 mg),分别在一个周期(28天)的第1天、第8天和第15天进行静脉输注。Enfortumab注册路径和临床研究数据可详见:重磅ADC/Keytruda组合疗法获FDA批准,OS和PFS翻倍!ADC联合PD-1/L1时代来临内容。
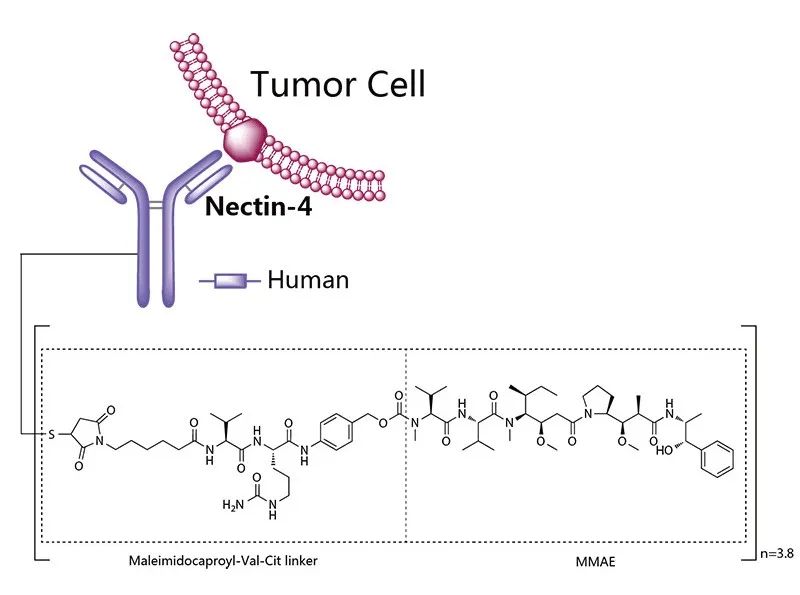
图2. Enfortumab结构,来源:药渡数据
基于EV-101研究剂量爬坡阶段药代动力学(PK)分析结果显示,Enfortumab在0.5-1.25 mg/kg剂量范围内,呈线性剂量比例性药代动力学特征,无明显蓄积[5]。Enfortumab和MMAE经一个周期给药后达到稳态,最大血药浓度(Cmax)分别为27.7 μg/mL和4.79 ng/mL,0至28天曲线下面积(AUC0-28d)分别为111 day*μg/mL和68.6 day*ng/mL,谷浓度为0.267 μg/mL和0.566 ng/mL。
截至2019年1月,共收集了4个临床研究中369名受试者的血样,进行Enfortumab和非偶联MMAE群体PK建模[5]。其中,Enfortumab通过一级消除三房室模型描述其PK特征,而一级消除二房室模型以及从Enfortumab到MMAE呈指数下降转换率描述非偶联MMAE PK特征,清除率(CL)分别为0.104 L/h和2.72 L/h,消除半衰期约为3.35天(80.5 h)和2.44天(58.5 h),如图3所示。
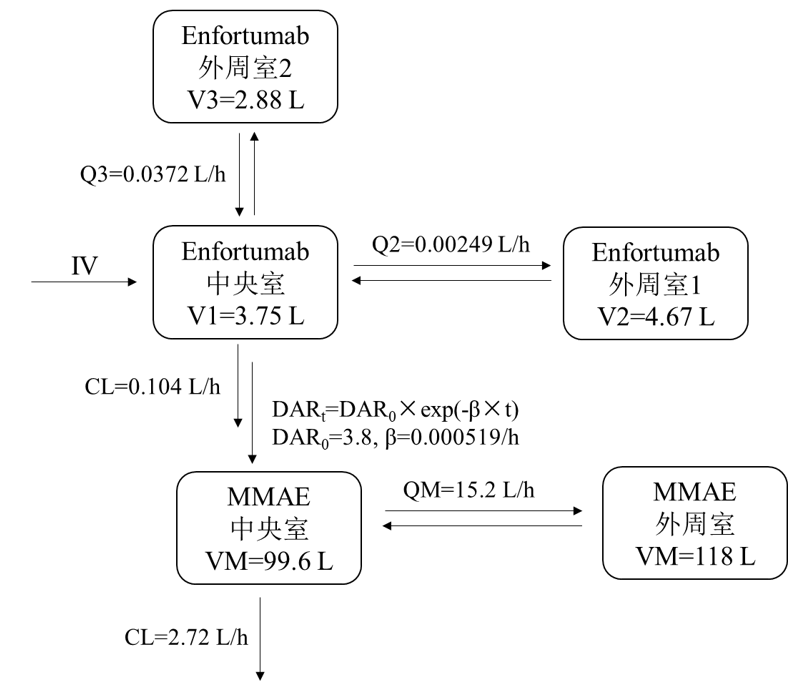
图3. 群体PK模型和参数
此外,Enfortumab群体PK模型将体重、性别、血红蛋白、基线肿瘤直径总和以及肿瘤类型纳入协变量分析,而MMAE模型则将白蛋白、ECOG评分、血红蛋白、胆红素、种族、体重和性别纳入协变量分析。结果显示,这些协变量影响无临床意义。
PART.
03
Enfortumab暴露量-效应关系
在暴露量效应关系(ER)分析方面,数据来源于在第一周期D1、D8和D15接受1.25 mg/kg Enfortumab的尿路上皮癌患者,随后以最 佳总体疗效(BOR)、持续应答时间(DOR)、无进展生存期(PFS)和总生存期(OS)作为疗效指标,进行暴露量与疗效关系分析。
其中,采用一元Logistic回归模型评价BOR与Enfortumab和游离MMAE暴露量的关系。从图4可以看出,Q2-Q4暴露量所预测的应答率可达50%左右且趋近平稳,表明超过1.25
mg/kg剂量可能并不能进一步带来疗效获益。此外,申办方还使用一元Cox比例风险模型评价DOR、PFS和OS与暴露量的关系,但具体结果未在审评报告中披露。
![暴露量和BOR的关系[5]](https://cimg.cphi.cn/img_Cphi_cn/news/2024_01/Mimg_2401190127500476.png)
图4. 暴露量和BOR的关系[5]
还通过一元Logistic回归模型,评估3级以上TRAE发生率与暴露量的关系。据图5所示,暴露量与不良事件呈正相关,但优势比相对较小,仅1.006,而在游离MMAE模型中,优势比也仅0.895,均无临床意义。
![暴露量和TRAE的关系[5]](https://cimg.cphi.cn/img_Cphi_cn/news/2024_01/Mimg_2401190127162451.png)
图5. 暴露量和TRAE的关系[5]
值得注意的是,披露的ER分析中仅纳入1.25 mg/kg剂量数据,但未纳入剂量0.5、0.75 mg/kg和1.0 mg/kg剂量组数据,因为较宽剂量范围更有利于趋势判断,对剂量选择上会更加清晰。有可能是因为其他剂量组纳入的瘤种较为杂乱,会影响对尿路上皮癌ER分析的结果和判断,也有可能申办方做了这类分析,但并未公开其结果。具体原因尚未可知。
PART.
04
Enfortumab在特殊人群中的
药代动力学特征
肾功能损伤人群
以基线估计的肌酐清除率用于评估肾功能损伤程度,并通过群体PK分析肾功能对Enfortumab和游离MMAE暴露量的影响。结果显示,轻度(60
![肾损伤对Enfortumab和非偶联MMAE第一周期暴露量的影响[5]](https://cimg.cphi.cn/img_Cphi_cn/news/2024_01/Mimg_2401190127845135.png)
图6. 肾损伤对Enfortumab和非偶联MMAE第一周期暴露量的影响[5]
肝功能损伤人群
群体PK建模和模拟结果显示,与正常肝功能人群相比,轻度肝损伤人群对Enfortumab和游离MMAE暴露量无明显差异[5],但未评估中度或重度肝损伤人群。FDA认为其他含有MMAE的ADC药物,在肝损伤研究中中度或重度肝损伤人群相较于正常肝功能人群,更易发生3级以上不良反应和死亡事件[5]。因此,监管机构建议禁止在中重度肝损人群中使用Enfortumab,并在说明书中加以规定。
PART.
05
小结
综上可见,Enfortumab除了检测ADC以外,还对有效载荷EMMA浓度进行检测,并均建立了群体PK模型和ER分析,其复杂程度高于常规的小分子药物,在临床药理方面的考量存在差异,在最 佳剂量的选择上需更加谨慎。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57