如果说,2022年本土创新国际化之路是接二连三的失败,那么经过一年调整,Biotech当前的出海形势,至少从数量上可以称得上接二连三的成功了。
9月,百济神州的PD-1抑制剂率先拉开大幕,获批在欧盟上市。 随后的10月,君实生物宣布,旗下PD-1产品登陆美国市场。 而11月9日,比预定的日期早了20多天,和黄医药推出的呋喹替尼(Fruzaqla),上市申请终于得到FDA许可。
呋喹替尼对于和黄医药的重要性不言而喻。 作为一家成立20余年的Biotech,呋喹替尼是和黄医药迈向“自我造血”的第一步。 自2018年国内获批上市以来,这款VEGFR抑制剂销售额节节攀升。 今年上半年,呋喹替尼卖出了5630万美元,同比增长12%。
值得注意的是,受益于1月跟武田制药达成的合作,光是就呋喹替尼的海外开发及商业化授权,和黄医药就拿到了4亿美元的首付款(上半年确认收到2.59亿美元)。 报告期内,和黄医药首次扭亏为盈。
尽管属于一过性的巨款,随着此次赴美上市目标的达成,和黄医药已开始赚取高达7.3亿美元的里程碑付款,而第一笔金额为3500万美元。 不管怎么说,这都是一个趋近正向循环的信号。
当然,呋喹替尼并不仅仅是和黄医药的商业化起点,更有望掀起治疗范式的转变。 纵向比较,这是过去10余年美国批准的首 款用于治疗转移性结直肠癌(mCRC)的靶向疗法,无论患者的生物标志物状态或既往的治疗种类如何。
和黄医药的故事,也可以理解成更宽泛的Biotech出海样本。
2022年5月,FDA拒绝和黄医药另一款定位为me-better的抗肿瘤药索凡替尼在美上市,这被认为是延续早前信达生物PD-1抑制剂面临的数据困境。 某种程度上,此次呋喹替尼的获批,进一步验证了本土新药进入国际的大门仍可被打开。 关键是,Biotech怎么找到自己的那把钥匙。
1
一个竞品都“so-so”的大市场
CRC是始于结肠或直肠的癌症。 援引国际癌症研究机构(IARC)的数据,这种疾病在全球常见癌症中排在第三位。 在2020年,CRC造成死亡人数预估超过93.5万人。
从地域上看,CRC的分布遍及世界。 在日本,CRC是最常见的癌症,2020年估计有14.8万例新增病例和6万例死亡;到了欧洲,CRC是第二大常见癌症,2020年约有52万例新增病例和24.5万例死亡。 而美国市场,2023年估计将新增15.3万例CRC新症以及5.3万例死亡。
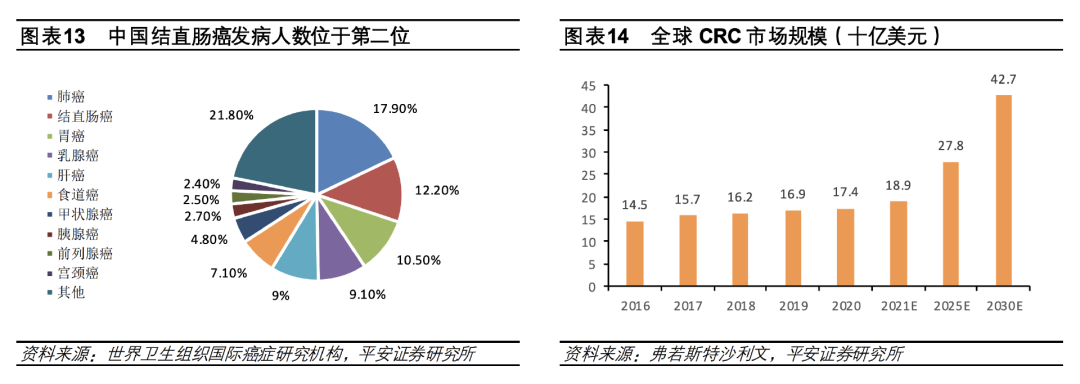
很不幸,虽然早期CRC能够通过手术切除,转移仍是CRC相关死亡的主要原因。 mCRC目前治疗结果不佳且治疗方案有限,仍然存在大量未被满足的医疗需求。
这方面的突破可以追溯到2012年。 彼时,FDA批准了由拜耳跟Onyx联合开发的瑞戈非尼(Stivarga)上市申请,用于治疗既往接受过以氟尿嘧啶、奥沙利铂和伊立替康为基础的化疗,以及既往接受过或不适合接受抗血管内皮 生长因子治疗、抗表皮生长因子受体治疗(RAS野生型)的mCRC。
3年后,一种新型口服抗代谢复方药物TAS-102(曲氟尿苷替匹嘧啶,Lonsurf)也在美国获批,用于对其他疗法(化疗及生物疗法)不再响应的难治性mCRC患者的治疗。
这两款产品的问世,的确增加了晚期CRC患者的用药选择。 可在一家本土Biotech的CMO看来,它们的疗效远非极 致——他用的描述词是“so-so”。
发表在Journal of the National Comprehensive Cancer Network的一项真实世界研究结果显示,瑞戈非尼是在每28天周期中每天一次共用药21天,容易出现3级手足综合征、疲劳、高血压和肝毒性发生率。 安全性也存在于TAS-102,在每28天周期的第1-5天、第8-12天给药,可能会出现较高的血液学毒性,特别是中性粒细胞减少症。
疗效方面,奠定TAS-102在mCRC中三线治疗地位的,主要来自RECOURSE和TERRA研究,二者的mOS分别为7.1个月、7.8个月,mPFS分别为2个月、2个月。 瑞戈非尼用于mCRC三线治疗则基于CORRECT和CONCUR试验。 前者显示,瑞戈非尼的mOS达6.4个月,这一数据在后者中为8个月。
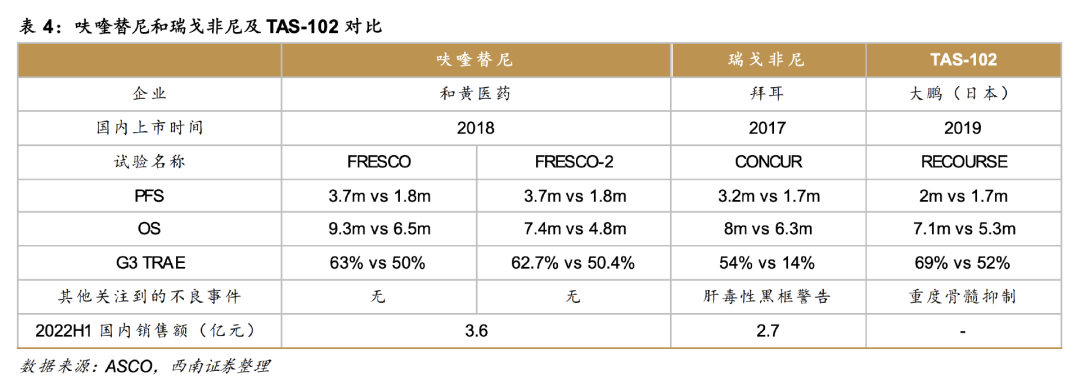
与前述相比,和黄医药开发的呋喹替尼,则要出色得多。
FRESCO研究指示,呋喹替尼在主要终点mOS上达到9.3个月(安慰剂为6.57个月),次要终点mPFS达到3.71个月(安慰剂组为1.84个月)。
另一项III期国际临床研究FRESCO-2,共纳入全球691例难治性mCRC患者。 其中,461例接受呋喹替尼治疗的患者mOS为7.4个月,mPFS为3.7个月;而230例安慰剂组患者的mOS为4.8个月,mPFS为1.8个月。
基于这些结果,11月9日,FDA批准呋喹替尼用于mCRC的三线治疗。
东吴证券研究所认为,呋喹替尼和瑞戈非尼在亚洲患者人群中的疗效并无明显差异,对三线CRC患者都具有显著疗效,并优于TAS-102。 但呋喹替尼的用药剂量仅5mg/d,远远低于其他抗血管生成药物。
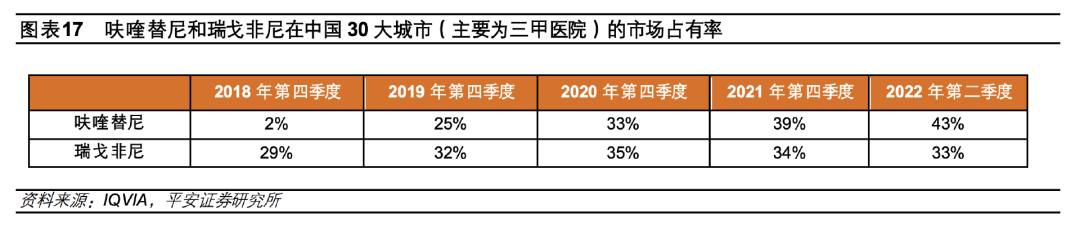
实际上,国内的销售额数据已经表现出呋喹替尼的潜力。 在2021年第四季度,呋喹替尼国内CRC三线治疗的销售占比就超过了瑞戈非尼。 西南证券测算,光是中国CRC三线治疗市场,2023年呋喹替尼的销售额就有望达到8.8亿元,2024年可突破至14.3亿元。
2020年,和黄医药跟礼来围绕呋喹替尼签订了一份合作修正案,双方将共同推动该药在中国的商业化,而礼来将向和黄医药支付呋喹替尼销售总额70%-80%的金额。
与武田制药的合作,同样会持续为和黄医药带来收入。 按照协议,后者可就包括商业销售在内的里程碑,收取额外的潜在付款外加基于净销售额的特许权使用费。
2
2023出海:撬动监管的支点
公告中,和黄医药除了提及国际临床研究FRESCO-2的支撑,还强调只在国内开展的FRESCO对新药获得FDA批准的作用。正是在这个维度上,呋喹替尼与前不久也成功抢滩的特瑞普利单抗,形成一组有意思的对照。
特瑞普利单抗获批之前,美国市场上并无PD-1抑制剂用于鼻咽癌治疗。这部分是因为,鼻咽癌属于一种地域性很强的癌症,主要集中在东南亚等地区。按照君实生物的合作伙伴Coherus统计,美国每年的新发鼻咽癌患者仅有2000人。
然而,特瑞普利单抗的获批,主要数据支撑来自POLARIS-02、JUPITER-02这两项研究。它们的共性之一,是都只纳入中国大陆、台湾地区以及新加坡患者的数据,没有涵盖美国、欧盟等其他区域的患者。
曾在中美两地产业界负责临床开发工作的行业人士称,对于罕见病药物的申报,FDA并不一定需要企业提供在美国本土开展的临床数据。也就是说,只要能够很大程度解决临床上未被满足的需求,尤其是无药可用的处境,药监部门也不会只盯着数据多样性不放。
2022年2月,FDA召开专家会,围绕信达生物和礼来合作开发的PD-1抑制剂上市申报数据展开讨论。当时的一个争议焦点,便是使用单一国家数据是否足以证明该药对美国患者的有效性。
无论是ODAC的投票结果,还是FDA次月做出的最终决定,信迪利单抗的“闯关”都被拒之门外。这种负面情绪也蔓延至同年5月的索凡替尼申报上。在CRL中,FDA表示,基于两项成功的中国III期研究以及一项美国桥接研究的数据包,尚不足以支持索凡替尼在美国获批治疗晚期神经内分泌瘤。
信迪利单抗的案例,还牵扯出另一段往事。2015年,中国药监部门发出一份临床试验数据核查公告,引发众多在研项目申请撤回。到去年的专家会上,FDA似乎仍对中国的临床数据持保留意见。
“我在很多家医院做过稽查,现在中国临床研究质量一点都不比美国的低。”一位从业者透露。这一观点,从中国医学科学院肿瘤医院副院长李宁那里也得到印证。
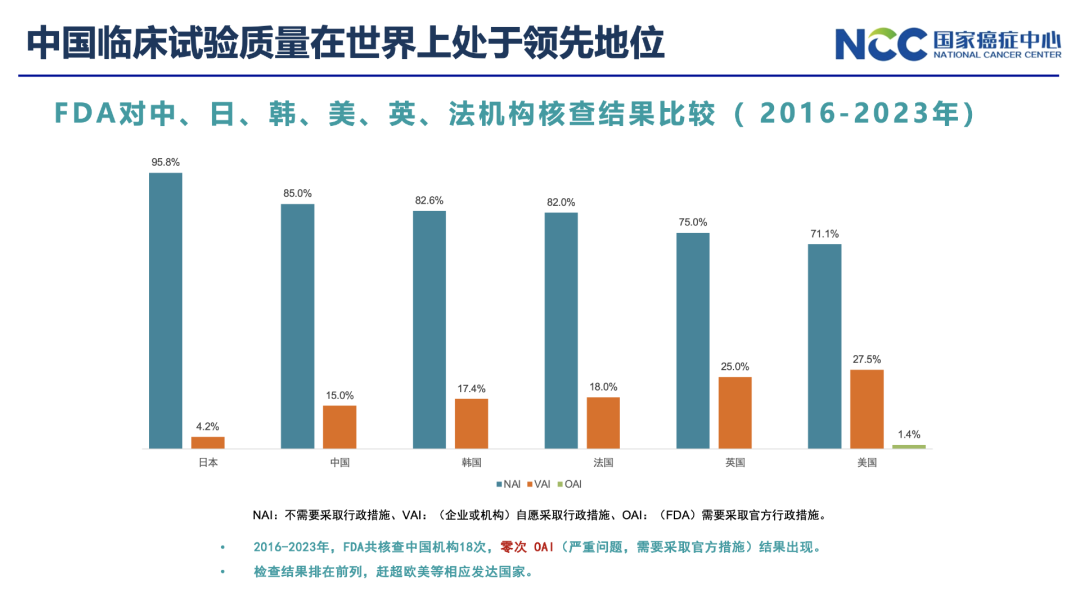
2016年至2023上半年,中国药企开发并获批上市的抗肿瘤新药共计62种。有37种新药(占比59.7%)被纳入2022版CSCO指南推荐使用,有15种新药(24.2%)被2023版NCCN指南采纳并推荐应用。“2016-2023年,FDA共核查中国机构18次,零次OAI。检查结果排在前列,不劣于欧美等相应发达国家。”李宁在一次报告上介绍道。
倘若特瑞普利单抗、呋喹替尼的例子尚且不能说是FDA对于监管风向上的改变,它们至少也表明,满足临床亟需是药物获批的金标准,而中国数据如若运用得当,也将推动产品走向国际。
应当说,美国市场并非呋喹替尼的终点站,正如它也不是特瑞普利单抗的终点站一样。
君实生物高级副总裁姚盛曾指出,FDA在全球有一系列合作监管部门,“FDA批准后这些国家一般会在半年内批准”。
今年以来,君实生物大举布局东南亚等鼻咽癌高发市场:先是3月,宣布与新加坡公司康联达技生成立合资公司,并将特瑞普利单抗在东盟九国的商业化权益授予后者;5月,又将印度、南非和中东的商业化权益,转让给印度的Dr.Reddy’s。
至于和黄医药与武田制药,对呋喹替尼的开发也有类似的算盘。6月,EMA受理了该药用于经治mCRC成人患者的上市许可申请;而9月,武田制药同样向日本厚生劳动省提交了相关申请。
除此之外,作为一款VEGFR1/2/3抑制剂,呋喹替尼可对VEGFR3的选择性是非VEGFR靶点的250倍,相比于其他的抗血管生成激酶抑制剂,具有更好的靶点选择性,良好的安全性,这也为它的销售峰值增加更多潜在空间。
弗若斯特沙利文估计,2020年VEGF/VEGFR疗法的全球市场约200亿美元,其中包括在约26种肿瘤类型中获批准的大分子和小分子药物。到2030年,全球该细分市场预计将增至521亿美元。
现阶段,和黄医药针对呋喹替尼在国内申请了多项注册性临床试验,核心适应症为晚期CRC、晚期胃癌、晚期乳腺癌。
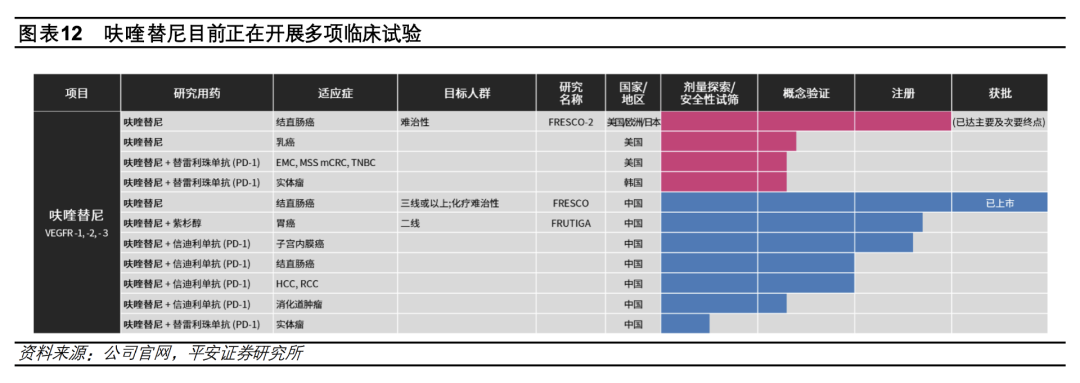
进展截至2022年11月
对于此次成功出海,和黄医药CEO苏慰国将之视为公司最新战略调整后的成效。
2022年末,这家Biotech启动了一项计划,旨在通过将精力集中在开发后期的项目、减少内部对早期研究的投入,以及寻求合作伙伴推动产品的境外商业化等举措,获得新一轮的业绩增长。
和黄医药CFO郑泽锋曾于去年早些时候表示,希望公司在五年内可以达到收支平衡,如果在未来几年可以得到一些商业化的成功,和黄医药收入大概会达到10亿美元左右,届时将是增长的研发开支平衡点。
就当前的情况看,借力MNC的和黄医药正在朝着上述目标加速小跑。对于其他苦于盈利的Biotech来说,这未尝不是一个值得借鉴的方法。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57