1月16日,FDA宣布批准Vertex Pharmaceuticals及其合作伙伴CRISPR Therapeutics共同开发的Casgevy (exagamglogene autotemcel) CAS9基因编辑细胞疗法,作为12岁及以上输血依赖性β-地中海贫血患者(TDT)的一次性治疗方法。
去年12月Casgevy获FDA批准用于治疗镰状细胞病(SCD),成为首 个进入美国市场的CRISPR基因编辑疗法。时隔月余,FDA再次批准Casgevy增加的适应症,用于治疗输血依赖性β-地中海贫血(TDT),比PDUFA日期提前了两个多月。Vertex和CRISPR Therapeutics预计FDA在3月30日之前对Casgevy的TDT作出决定。
Vertex首席执行官Reshma Kewalramani在一份声明中表示:“继Casgevy获批治疗SCD后,TDT的批准比PDUFA日期提前了很多,这是令人兴奋的。我们期待Casgevy能成为TDT患者新的可治愈的治疗选择”。
根据Vertex公司的公告,该公司正在与医院合作建立一个授权治疗中心(ATC)网络,旨在为更多的患者提供治疗,“未来几周”将有更多的治疗中心上线。迄今为止,全国有9家ATCs可以为TDT和镰状细胞病患者提供Casgevy。目前美国约有1000名患者有资格接受这种一次性治疗。
成人血红蛋白(HbA)包含2条α链和2条β链,而胎儿血红蛋白(HbF)则与之不同,包含α链和γ链。在红血细胞中,HbF是携带氧气的血红蛋白的形式,在胎儿发育期间自然存在,随着胎儿脱离母体开始自主呼吸,与氧亲和更高的HbF会向HbA转变。而BCL11A基因表达的BCL11A蛋白, 对HbF蛋白的表达起负性调控作用。
Casgevy是一种非病毒、体外CRISPR/Cas9基因编辑的、一次性单剂量细胞疗法,用于治疗符合条件的SCD或TDT患者。
Casgevy的工作原理是干扰BCL11A的功能,Casgevy通过Cas9定点切割BCL11A基因,使其失活,从而解除其对HbF表达的抑制。这种编辑导致产生高水平的HbF,从而缓解或消除SCD患者的疼痛及血管闭塞性危象 (VOC),并且能缓解TDT患者的输血需求,使TDT患者摆脱长期输血的困扰。
Casgevy的工作原理示意图
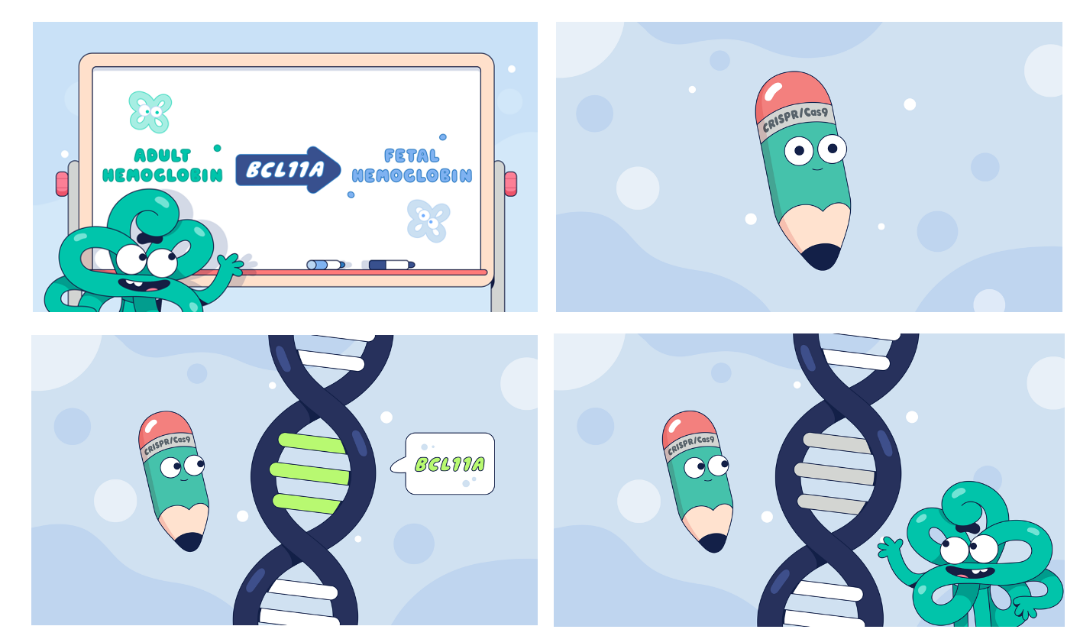
图片来源:www.casgevy.com
与Casgevy同时获批治疗SCD的,还有蓝鸟生物公司(bluebird bio)的细胞基因疗法Lyfgenia,这款药物使用慢病毒载体进行基因修饰。然而,鉴于Casgevy的标价为每位患者220万美元,较之Lyfgenia的310万美元标价,Casgevy似乎更具优势。此外,就安全性而言,Lyfgenia可能致癌,因此FDA给其打上了黑框警告,在Casgevy没有。
在昨天的声明中,Vertex还未提供Casgevy治疗TDT的定价。蓝鸟生物的基因疗法Zynteglo标价280万美元,于2022年8月被FDA批准用于治疗β-地中海贫血。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57