2024年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)已圆满闭幕。正大天晴药业集团1类创新药安罗替尼(小分子多靶点受体酪氨酸激酶抑制剂)、派安普利单抗(PD-1抑制剂)和贝莫苏拜单抗(TQB2450,PD-L1抑制剂)本次共有11项研究入选壁报展示,涉及伴肝转移消化道肿瘤、食管癌、肝细胞癌、胆道系统肿瘤、结直肠癌领域。
2024 ASCO GI
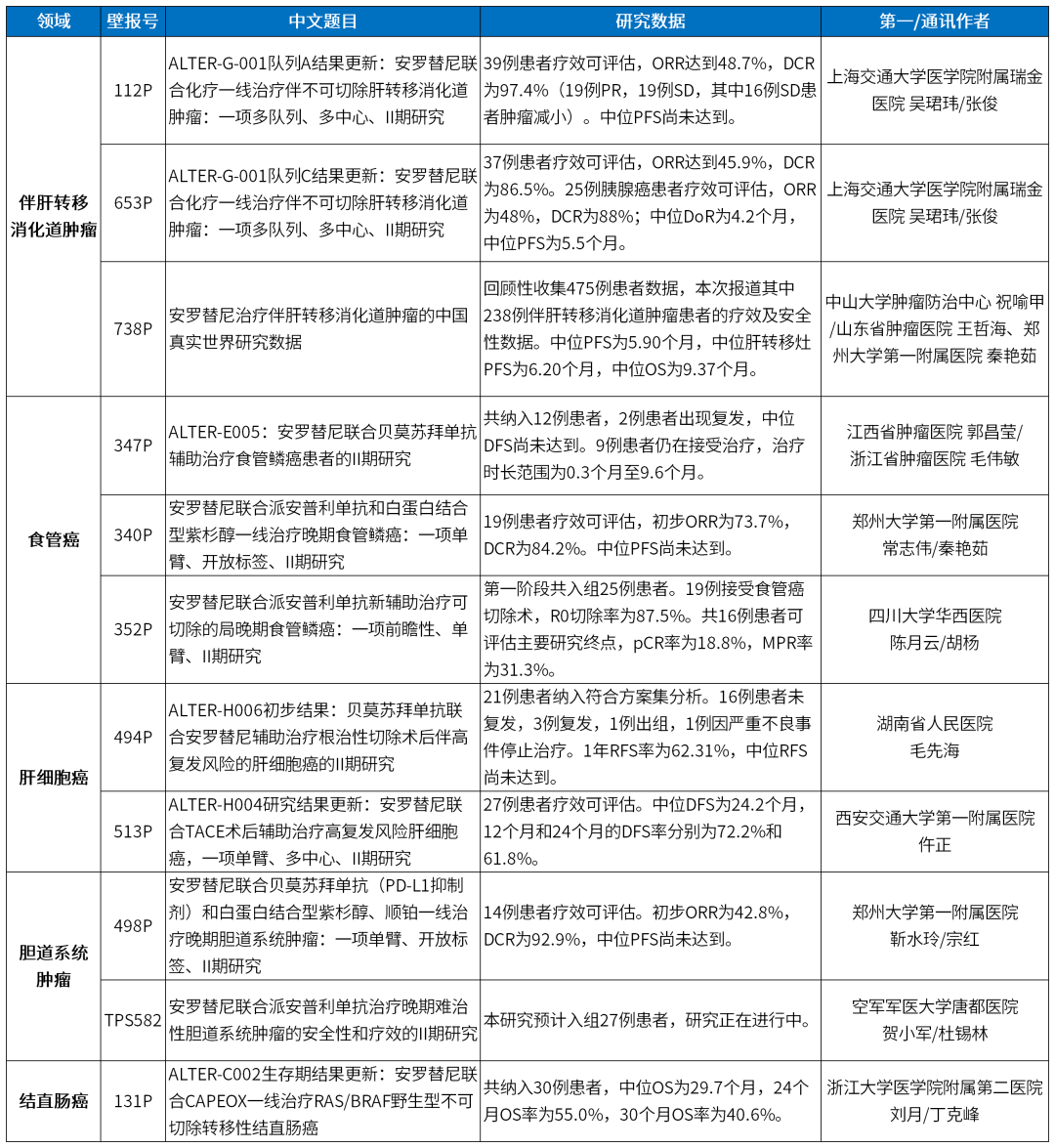
正大天晴消化道肿瘤11项研究数据一览表
图片来源:正大天晴企业官微
伴肝转移消化道肿瘤
112P:ALTER-G-001队列A结果更新:安罗替尼联合化疗一线治疗伴不可切除肝转移消化道肿瘤:一项多队列、多中心、II期研究
通讯作者:上海交通大学医学院附属瑞金医院 张俊
第一作者:上海交通大学医学院附属瑞金医院 吴玮
内容概要:
ALTER-G-001是一项多队列、多中心的II期研究,本次ASCO GI大会公布了队列A的更新结果。队列A患者接受安罗替尼(12 mg,po,qd,d1-14,q3w)+奥沙利铂(130 mg/㎡,iv,d1,q3w)+卡培他滨(850 mg/㎡,po,bid,d1-14,q3w)治疗6周期(每周期3周),如肝转移灶经影像评估未转化为可切除,治疗6个疗程后,疗效评估为完全缓解(CR)/部分缓解(PR)/疾病稳定(SD)的患者使用安罗替尼联合卡培他滨节拍化疗(500 mg,po,bid,d1-21,q3w)维持治疗,直至疾病进展或不可耐受。主要终点为客观缓解率(ORR,RECIST v1.1),次要终点包括无进展生存期(PFS)、总生存期(OS)、疾病控制率(DCR)、持续缓解时间(DOR)、肝转移灶的转化率和安全性。
截至2023年9月14日,队列A共纳入45例结直肠癌患者,诱导治疗后,8例患者接受手术;23例患者在组(10例正在接受维持治疗),最长治疗持续时间(DoT)为13.7个月。39例患者疗效可评估,ORR达到48.7%,DCR为97.4%(19例PR,19例SD,其中16例SD患者肿瘤减小)。中位PFS尚未达到。≥3级治疗期间出现的不良事件(TEAEs)发生率为33.3%,主要包括中性粒细胞计数降低(11.1%)、高血压(6.7%)和血小板计数降低(6.7%)。
研究表明,安罗替尼联合化疗一线治疗伴不可切除肝转移结直肠癌患者具有良好的疗效和可控的安全性,可能为这部分患者群体提供了一种新的治疗策略。
653P:ALTER-G-001队列C结果更新:安罗替尼联合化疗一线治疗伴不可切除肝转移消化道肿瘤:一项多队列、多中心、II期研究
通讯作者:上海交通大学医学院附属瑞金医院 张俊
第一作者:上海交通大学医学院附属瑞金医院 吴珺玮
内容概要:
ALTER-G-001是一项多队列、多中心的II期研究,本次ASCO GI大会公布了队列C的更新结果。队列C患者接受安罗替尼(12 mg,po,qd,d1-14,q3w)+标准化疗治疗6周期(每周期3周),如肝转移灶经影像评估未转化为可切除,治疗6个疗程后,疗效评估为CR/PR/SD的患者使用安罗替尼联合卡培他滨节拍化疗(500 mg,po,bid,d1-21,q3w)维持治疗,直至疾病进展或不可耐受。主要终点为ORR(RECIST v1.1),次要终点包括PFS、OS、DCR、DOR、肝转移灶的转化率和安全性。
截至2023年9月14日,队列C共纳入41例患者,其中包括胰腺癌(PC,n=29)、胃癌(GC,n=6)、胆道癌(BTC,n=5)、十二指肠癌(n=1),诱导治疗后,4例患者接受手术(1例PC、2例GC、1例BTC);37例患者疗效可评估,ORR达到45.9%,DCR为86.5%(17例PR,15例SD,其中12例SD患者肿瘤减小)。25例胰腺癌患者疗效可评估,ORR为48%,DCR为88%;中位DOR为4.2个月(95%CI:2.0-6.3),中位PFS为5.5个月(95%CI:4.7-6.3)。≥3级TEAEs发生率51.2%,主要包括中性粒细胞计数降低(19.5%)、白细胞计数降低(12.2%)和血小板计数降低(9.8%)。
研究表明,安罗替尼联合化疗一线治疗伴不可切除肝转移消化道肿瘤尤其是胰腺癌患者具有良好的疗效,且安全性可耐受,可能为这部分患者群体提供了一种新的治疗策略。
738P:安罗替尼治疗伴肝转移消化道肿瘤的中国真实世界研究数据
通讯作者:山东省肿瘤医院 王海、郑州大学第一附属医院 秦艳茹
第一作者: 中山大学肿瘤防治中心 祝喻甲
内容概要:
回顾性收集了2016年1月至2023年2月就诊于山东省肿瘤医院、郑州大学第一附属医院、中山大学肿瘤防治中心等5家大型医院的实体瘤伴肝转移且接受安罗替尼治疗的患者475例,其中消化道肿瘤患者238例(包括胃癌73例、结直肠癌71例、食管癌46例、胆道癌24例、胰腺癌24例)。排除用药期间接受立体定向放疗(SBRT)、立体定向消融放疗(SABR)、全脑放疗(WBRT)或肝动脉化疗栓塞(TACE)的患者。主要终点为PFS和ORR,次要终点为OS、 肝转移灶PFS、肝转移灶ORR和安全性。
截至2023年2月28日,中位PFS为5.90个月(95%CI:5.23-6.77),中位肝转移灶PFS为6.20个月(95%CI:5.27-6.77),中位OS为9.37个月(95%CI:8.40-NR)。不同消化道肿瘤类型的PFS、肝转移灶PFS、OS均无显著差异。BMI<18.5的患者的PFS(p=0.005)和肝转移灶PFS(p=0.01)更短。安全性整体良好可控,TEAEs发生率为12.6%,≥3级TEAEs发生率为1.3%。最常见的治疗相关不良事件(TRAE)为白细胞计数降低(5.9%)。
该研究是首 个关于中国伴肝转移消化道肿瘤患者应用安罗替尼治疗的真实世界研究数据报道,结果表明,安罗替尼可作为伴肝转移消化道肿瘤患者的一种有效可行、安全性可控的治疗选择。
食管癌
347P:ALTER-E005:安罗替尼联合贝莫苏拜单抗辅助治疗食管鳞癌患者的Ⅱ期研究
通讯作者:浙江省肿瘤医院 毛伟敏
第一作者:江西省肿瘤医院 郭昌莹
内容概要:
自2022年8月至2023年8月,共纳入12例经组织学证实为T1-2N1-3M0或T3-4NanyM0 食管鳞癌(ESCC)患者,患者接受根治性(R0)切除术且术后6-12周内影像学检查无复发。入组患者接受安罗替尼(12 mg,po,d1-14,q3w)联合贝莫苏拜单抗(1200 mg,iv,d1,q3w)治疗最多16周期或直至复发。主要终点为无病生存期(DFS),次要终点包括安全性、1年DFS率、3年DFS率、1年OS率和3年OS率。
截至2023年8月25日,中位随访时间为5.1个月。2例患者出现复发,中位DFS尚未达到。9例患者仍在接受治疗,治疗时长范围为0.3个月至9.6个月。3级TEAEs发生率为25%,包括手足综合征(16.7%),肝功能异常(8.3%)和免疫相关肝炎(8.3%),未发生4级及以上TEAE。
研究表明,安罗替尼联合贝莫苏拜单抗辅助治疗食管鳞癌初步显示出良好的疗效和可控的安全性。
340P:安罗替尼联合派安普利单抗和白蛋白结合型紫杉醇一线治疗晚期食管鳞癌:一项单臂、开放标签、II期研究
通讯作者:郑州大学第一附属医院 秦艳茹
第一作者:郑州大学第一附属医院 常志伟
内容概要:
自2022年7月至2023年8月,共纳入23例经组织学确诊、不可切除的局晚期复发性或转移性ESCC患者,患者既往未接受过系统治疗或在新辅助治疗/辅助治疗/根治性切除术后复发>6个月。给予安罗替尼(12 mg,po,d1-14,q3w)+派安普利单抗(200 mg,iv,d1,q3w)+白蛋白结合型紫杉醇(220 mg/㎡,iv,d1,q3w)治疗直至疾病进展或不可耐受。主要终点为PFS,次要终点为ORR、DCR、OS和安全性。
19例患者疗效可评估,14例患者达PR,2例SD,3例未评估(NE)。初步ORR为73.7%, DCR为84.2%。中位PFS尚未达到。最常见的TEAEs(≥20%)为白细胞计数降低(30%)和贫血(30%)。常见的≥3级TEAEs包括白细胞计数降低(9%)、ALT升高(4%)、AST升高(4%)、高血压(4%)和腹泻(4%)。
研究表明,安罗替尼联合派安普利单抗和白蛋白结合型紫杉醇一线治疗晚期ESCC显示出令人鼓舞的疗效和可控的安全性。
352P:安罗替尼联合派安普利单抗新辅助治疗可切除的局晚期食管鳞癌:一项前瞻性、单臂、II期研究
通讯作者:四川大学华西医院 胡杨
第一作者:四川大学华西医院 陈月云
内容概要:
本研究采用Simon二阶段最小最大化设计,计划纳入40例经病理学确诊、可切除的局晚期ESCC患者( 临床分期III-IVa),第一阶段计划入组25例,若有>3例患者达到病理完全缓解(pCR),进入第二阶段,第二阶段计划入组15例。自2023年1月至2023年9月,第一阶段共入组25例患者,给予安罗替尼(8 mg,po,d1-14,q3w)+派安普利单抗(200 mg,ivgtt,d1,q3w)新辅助治疗2周期,4周以后,患者排除禁忌症后接受根治性手术。主要终点为pCR率,次要终点为肿瘤退缩分级(TRG)、R0切除率、ORR和安全性。
截至2023年9月15日,19例患者接受了食管癌切除术,R0切除率为87.5%。共16例患者可评估pCR率,为18.8%(3/16);主要病理缓解(MPR)率为31.3%(5/16)。共25例患者疗效可评估,ORR为48.0%, DCR为96.0%。1-2级TRAEs发生率为84.0%,3级TRAEs发生率为12.0%(2例血压升高和1例肝酶升高)。未发生4-5级AE。最常见的任意级别TRAEs包括高血压(28%)、手足综合征(20%)、乏力(20%)、腹痛(12%)、牙痛(12%)、肝酶升高(4%)。
研究初步结果表明,安罗替尼联合派安普利单抗新辅助治疗可切除的局晚期ESCC显示出令人鼓舞的疗效和可控的安全性。
肝癌
494P:ALTER-H006初步结果:贝莫苏拜单抗联合安罗替尼辅助治疗根治性切除术后伴高复发风险的肝细胞癌的II期研究
通讯作者:湖南省人民医院 毛先海
第一作者:湖南省人民医院 毛先海
内容概要:
自2022年1月至2023年8月,共纳入22例肝细胞癌(HCC)患者,其中21例患者纳入符合方案集分析。入组标准为经组织病理学确诊、ECOG PS 0-1、Child Pugh A、在R0切除术后4-8周伴以下任意一项复发高危风险因素(肿瘤数量≥4个;门静脉癌栓:Vp1/2;肝静脉癌栓:Vv1/2)。患者在接受R0切除术后4-8周使用安罗替尼(12 mg,po,d1-14,q3w)和贝莫苏拜单抗(1200 mg,iv,d1,q3w)治疗直至复发或无法耐受,最长治疗时间为1年。主要终点为1年无复发生存期(RFS)率,次要终点为RFS、1年OS率和安全性。
根据RECIST v1.1标准,21例患者中,16例患者未复发,3例复发,1例出组,1例因严重不良事件停止治疗。1年RFS率为62.31%(95%CI:17.15-88.08),中位RFS尚未达到。TRAEs发生率为73%。3级TRAEs发生率为27%,包括高血压(13.5%)、中性粒细胞计数降低(9%)、出血(4.5%)。
研究表明,贝莫苏拜单抗联合安罗替尼辅助治疗根治性切除术后伴高复发风险的HCC患者,展示出潜在的疗效,且安全性可耐受。
513P:ALTER-H004研究结果更新:安罗替尼联合TACE术后辅助治疗高复发风险肝细胞癌,一项单臂、多中心、II期研究
通讯作者:西安交通大学第一附属医院 仵正
第一作者:西安交通大学第一附属医院 仵正
内容概要:
截至2023年3月2日,共纳入29例接受肝切除术的HCC患者,且至少存在1个术后复发高危因素:肿瘤直径≥5 cm且<10 cm、肿瘤数量≥3、肿瘤微血管浸润级别为M1或M2、接受门静脉癌栓切除(程氏分型I/II)。患者肝切除术后1-2个月内接受常规TACE治疗,且在TACE治疗后第3-5天,患者口服安罗替尼(12 mg,qd,d1-14,q3w),直至疾病复发或毒性不可耐受。主要终点为DFS,次要终点包括1年DFS率、至复发时间(TTR)和安全性。
27例患者疗效可评估。中位随访时间为21.8个月。中位DFS为24.2个月(95%CI:NA-NA),12个月和24个月的DFS率分别为72.2%(95%CI:50.4-85.7)和61.8%(95%CI:38.8-78.3)。TRAEs发生率为66.7%。3级TRAEs发生率为14.8%,包括高血压(7.4%)、白细胞计数降低(7.4%)和腹水(3.7%),未发生4级或5级TRAE。
研究表明,安罗替尼联合TACE辅助治疗高复发风险HCC患者显示出令人鼓舞的疗效和可耐受的安全性。
胆道系统肿瘤
498P:安罗替尼联合贝莫苏拜单抗(PD-L1抑制剂)和白蛋白结合型紫杉醇、顺铂一线治疗晚期胆道系统肿瘤:一项单臂、开放标签、II期研究
通讯作者:郑州大学第一附属医院 宗红
第一作者:郑州大学第一附属医院 靳水玲
内容概要:
自2023年4月至2023年8月,共纳入18例经组织学确诊、既往未接受过系统治疗的转移性或局晚期胆道系统肿瘤(BTC)患者,采用安罗替尼(10 mg,po,d1-14,q3w)+贝莫苏拜单抗(1200 mg,iv,d1,q3w)+白蛋白结合型紫杉醇(200 mg/㎡,iv,d1,q3w)+顺铂(60 mg/㎡,iv,d1,q3w)治疗,序贯安罗替尼联合贝莫苏拜单抗维持治疗,直至疾病进展或毒性不可耐受。主要终点为ORR,次要终点包括PFS、OS、DCR、安全性和生物标志物探索性分析。
14例患者疗效可评估。根据RECIST v1.1标准,6例患者达到PR、7例SD、1例疾病进展(PD),初步ORR为42.8%,DCR为92.9%,中位PFS尚未达到。最常见的TEAEs(发生率>30%)包括白细胞计数降低(67%)、发热(39%)、四肢疼痛(33%)和全身乏力(28%)。常见的≥3级TEAEs为白细胞计数降低(28%)、发热(6%)、全身乏力(6%)、胃痛(6%)、口腔粘膜炎(6%)等。
研究初步表明,安罗替尼联合贝莫苏拜单抗和白蛋白结合型紫杉醇、顺铂一线治疗晚期胆道系统肿瘤,展现出令人鼓舞的疗效和可控的安全性。
TPS582:安罗替尼联合派安普利单抗治疗晚期难治性胆道系统肿瘤的安全性和疗效的II期研究
通讯作者:空军军医大学唐都医院 杜锡林
第一作者:空军军医大学唐都医院 贺小军
内容概要:
本研究预计入组27例患者。主要纳入标准为经组织学或细胞学证实、既往至少一线化疗失败或无法接受一线标准治疗的胆囊癌、肝内胆管癌和肝外胆管癌。主要排除标准为既往使用过VEGFR靶点抑制剂(包括安罗替尼)、PD-(L)1抑制剂或CTLA-4抑制剂药物治疗,出血风险较高。
患者接受安罗替尼(12 mg,po,d1-14,q3w)联合派安普利单抗(200 mg,iv,d1,q3w)治疗,直至疾病进展或毒性不可耐受。主要终点为ORR(RECIST v1.1),次要终点包括DCR、PFS、OS和安全性。目前研究正在进行中。
结直肠癌
131P:ALTER-C002生存期结果更新:安罗替尼联合CAPEOX一线治疗RAS/BRAF野生型不可切除转移性结直肠癌
通讯作者:浙江大学医学院附属第二医院 丁克峰
第一作者:浙江大学医学院附属第二医院 刘月
内容概要:
自2019年11月至2021年2月,共纳入30例既往未接受过全身治疗的RAS/BRAF野生型不可切除mCRC患者。其中26例(86.7%)为左侧结肠或直肠癌,25例(83.3%)有肝转移。给予安罗替尼(12 mg,po,d1-14,q3w)、卡培他滨(850 mg/m2 ,po,d1-14,q3w)和奥沙利铂(130 mg/m2,iv, d1, q3w)治疗6个周期,随后采用安罗替尼和卡培他滨维持治疗直到疾病进展。主要终点为ORR,次要终点为安全性、DCR、DOR和PFS。
截至2023年5月29日,中位随访时间为31.7个月,中位OS为29.7个月(95% CI:21.2-38.2),24个月OS率为55.0%(95%CI:35.4%-70.9%),30个月OS率为40.6%(95%CI:21.6%-58.9%)。
研究表明,安罗替尼联合CAPEOX获得了较好的OS获益,并显示出作为mCRC一线治疗的潜在疗效,安全性可控。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57