2024年1月3日,第一三共CDH6 ADC DS-6000国内获批临床,用于治疗既往接受过至少一线系统治疗的铂耐药高级别卵巢癌、原发性腹膜癌或输卵管癌。
同年1月8日,荣昌生物开发的MSLN ADC RC88获得FDA授予的快速通道资格,用于铂耐药复发性上皮性卵巢癌、输卵管癌和原发性腹膜癌。
卵巢癌为高发病率、高死亡率妇科肿瘤,根据组织病理学分类以上皮性肿瘤最为常见,其又可细分为高级别浆液性癌、子宫内膜样癌等[1]。
此外,无铂间期(PFI)也是卵巢癌常见的分类标准。PFI即患者完成化疗疗程后,肿瘤不再复发的间期或者复发的间期延长。一般地,当PFI超过6个月复发的定义为铂敏感型,而PFI在6个月内复发的则称为铂耐药卵巢癌[2]。其中,后者相较于前者不论是应答率还是无进展生存期(PFS)、总生存期(OS)均显著减少,治疗选择有限,是目前卵巢癌的治疗难点和焦点。
PART.
01
PARP抑制剂和
免疫检查点抑制剂的起起伏伏
众所周知,自2014年首 个PARP抑制剂奥拉帕利的上市,为卵巢癌的治疗带来了新的突破,一度成为明星产品。国内外各大企业也开始研发属于自己的PARP抑制剂。其在卵巢癌的应用范围上也在不断扩大,从复发铂敏感后线治疗、复发铂敏感的维持治疗、复发铂耐药卵巢癌的后线治疗到卵巢癌的一线维持治疗,可谓是大放异彩。但好景不长,随着验证性临床数据的披露,发现PARP抑制剂在临床疗效上并无获益,使得多个PARP抑制剂,如奥拉帕利、尼拉帕利和芦卡帕利,被FDA撤销复发铂敏感和复发铂耐药卵巢癌后线治疗的适应症。而铂耐药卵巢癌便再次进入无药可用的阶段。
尽管研究热点免疫检查点抑制剂也一直在涉猎卵巢癌领域,积极探索单药以及与各种机制药物联合,如免疫联合化疗、免疫联合抗血管、免疫联合PARP抑制剂,但结果却不像在非小细胞肺癌适应症那样顺风顺水,反而是一片惨淡,未见突破。
PART.
02
各类ADC药物百花齐放
ImmunoGen公司开发的叶酸受体α(FRα)ADC Mirvetuximab的获批上市,可谓是一石激起千层浪,为卵巢癌领域带来新的突破和机遇。
此外,其他新型靶点ADC也陆续进入大众视野,为铂耐药卵巢癌治疗开疆拓土。2024年1月3日,第一三共CDH6 ADC DS-6000国内获批临床,用于治疗既往接受过至少一线系统治疗的铂耐药高级别卵巢癌、原发性腹膜癌或输卵管癌。同年1月8日,荣昌生物开发的MSLN ADC RC88获得FDA授予的快速通道资格,用于铂耐药复发性上皮性卵巢癌、输卵管癌和原发性腹膜癌。详情可见:荣昌生物又一款重量级ADC获美国FDA快速通道资格,靶向MSLN,治疗卵巢癌等肿瘤。
01
FRα ADC
2022年11月14日,FDA基于一项名为0417的单臂临床研究批准Mirvetuximab(索米妥昔单抗)上市,用于治疗接受过1到3种系统治疗且FRα阳性、铂耐药的上皮性卵巢癌、输卵管癌或原发性腹膜癌[3],这也是首 款获批上市的FRα ADC药物。2023年SGO大会上更新了其单臂数据,共计105例患者为疗效可评估,ORR为32.4%,中位DOR 6.9个月,中位OS 15个月[4]。2023年12月,其验证性临床III期研究MIRASOL数据发表在新英格兰杂志上[5],与对照组化疗相比,索米妥昔单抗中位PFS延长1个多月(5.62 vs 3.98),中位OS延长近4个月(16.46 vs 12.75)。中美华东制药则更是以独到的眼光在其上市前,以3亿美元引进该款ADC。
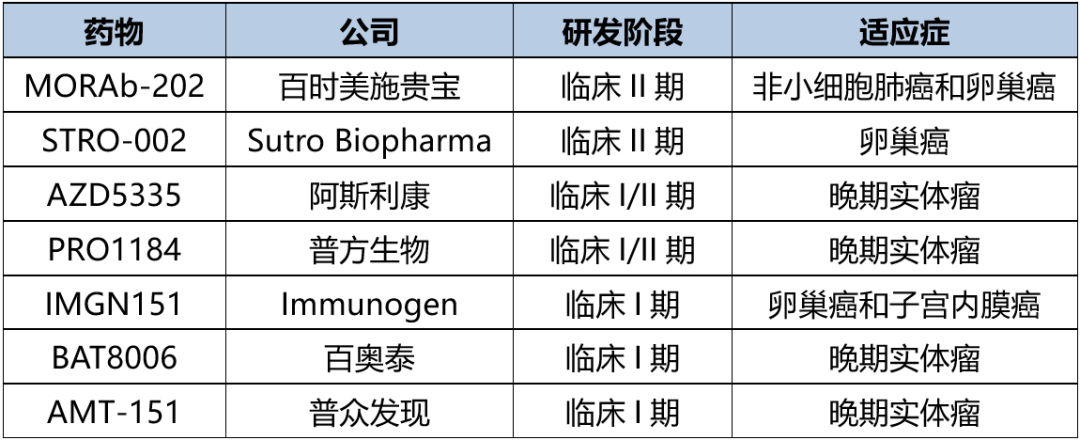
国内外已有多款FRα ADC处于临床阶段。目前,除已上市的索米妥昔单抗外,研发进展较靠前的是百时美施贵宝的MORAb-202和Sutro Biopharma的STRO-002。相较于开展妇科肿瘤适应症,MORAb-202可谓是独树一帜,其优先在非小细胞肺癌中开展了临床II期研究,可能也是想在众多FRα ADC中脱颖而出,让我们期待后续的临床结果。而国内企业普方生物研发的PRO1184在今年1月初获得FDA授予快速通道资格,用于治疗表达FRα的高级别浆液性或子宫内膜样铂耐药的卵巢癌。
表1. 临床在研的FRα ADC
02
CDH6 ADC
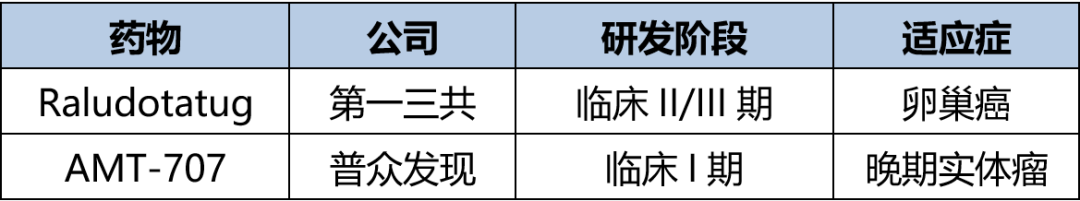
CDH6(人钙粘蛋白-6)是一种钙粘蛋白家族蛋白,大约在65%至85%的卵巢肿瘤细胞中有所表达[6]。该领域目前已处于临床阶段的产品仅两个,如表2所示。其中,进展最快的即第一三共开发的Raludotatug(DS-6000),目前处于临床II/III期,以研究者选择的化疗作为对照组,纳入约650例至少接受过1线不超过3线系统治疗的复发铂耐药卵巢癌。临床II期主要终点为BICR评估(盲态独立中心评估)的ORR,临床III期则为BICR评估的PFS,预计2027年完成。早期数据在2023 ESMO大会上有所披露,在复发铂耐药卵巢癌中ORR为46%,中位DOR为11.2个月,中位PFS为7.9个月[7]。值得注意的是,相较于Mirvetuximab,Raludotatug并未筛选生物标志物,意味着其适用人群可能广于Mirvetuximab。
AMT-707于2023年12月26日获NMPA临床许可,拟开发治疗晚期实体瘤,成为首 个国内自主研发进入临床的CDH6 ADC。CDH6 ADC尚未有上市药物,疗效和安全性尚未得到确证,其成药性有待进一步确认,药渡后续将会持续跟踪报道。
表2. 临床在研的CDH6 ADC
03
MSLN ADC
MSLN又称间皮素,已发现MSLN蛋白在85%-90%的间皮瘤,80%-85%的胰腺癌和60%-65%的肺癌、卵巢癌和胆管癌中均有表达。但该靶点ADC药物的开发并不顺利,拜耳的Anetumab和Amatuximab以及百时美施贵宝的BMS-986148完成临床研究后就再无进一步临床进展,RG-7600临床I期终止。目前仅国内两家企业开发的MSLN ADC处于临床阶段。其中,荣昌生物开发的MSLN ADC RC88处于关键临床II期,用于治疗复发铂耐药卵巢癌。其实,对于MSLN ADC药物的开发更像是一场豪赌,结局如何尚未可知。
表3. 临床在研的MSLN ADC

PART.
03
小结
综上,从目前来看,针对这类卵巢癌的治疗还得是以细胞毒药物作为backbone才能显现疗效。而各类ADC百家争鸣,是否真的能成为铂耐药卵巢癌的主场,让我们共同期待。铂耐药卵巢癌的药物开发和探索之路道阻且长,希望有更多新靶点、新机制的药物出现,为这类患病人群带来更多治疗选择。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57