近期,成立仅3年多的生物制药公司CG Oncology在33岁华裔带领下于纳斯达克成功上市。
值得注意的是,CG Oncology尚未有商业化产品,仅凭一款临床3期溶瘤病毒疗法Cretostimogene获得投资者青睐,公开募资3.8亿美元,并在上市当天收盘大涨约100%!
透过层层缝隙,2024年的生物医药领域,终是照进了一道光。
01
仅凭1款临床产品,
募资3.8亿美元
CG Oncology是一家成立于2020年开发膀胱癌溶瘤免疫疗法的生物制药公司。
1月24日,CG Oncology宣布首次公开募股2千万股,定价为每股19美元。所有股份均由CG Oncology提供。在扣除承销折扣和佣金以及其他发行费用之前,此次发行的总收益预计为3.8亿美元(图1)[1,2]。
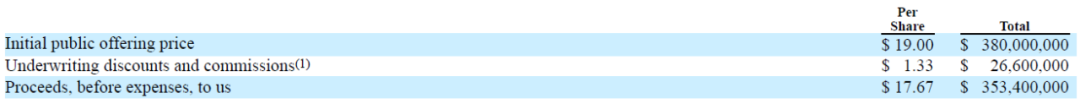
图1 CG Oncology股票发行价
图片来源:参考文献2
1月25日,CG Oncology在美国纳斯达克上市,股票代码“CGON“,开盘价为29美元,较发行价上涨52.6%;收盘价为37.17美元,较发行价上涨95.63%;以收盘价计算,公司市值约22.48亿美元。
资本市场的热烈追捧,源于CG Oncology管线——溶瘤病毒疗法Cretostimogene,用于治疗对卡介苗(BCG)无反应的高危NMIBC患者。
美国癌症协会估计,到2023年,美国将有超过82,000人被诊断出患有膀胱癌,并将导致近17,000人死亡,非肌浸润性膀胱癌(NMIBC)是膀胱癌的一种,具有很高的复发率。据估计,大约15%-61%的高危NMIBC患者会在治疗后一年内复发,大约31%-78%的NMIBC患者会在治疗后五年内复发或继发性膀胱癌,具体取决于危险因素[2]。
卡介苗是目前高危NMIBC的标准治疗方法。然而卡介苗治疗有一定局限性、耐药性,而且有些患者不愿接受根治性膀胱切除术或完全切除膀胱,这些患者的治疗需求存在重大未满足的需求。
溶瘤病毒疗法Cretostimogene横空出世。
CG Oncology在临床上针对Cretostimogene开展多项试验,包括临床3期的BOND-003、PIVOT-006,临床2期的CORE-001和临床1期的CORE-008(图2)。
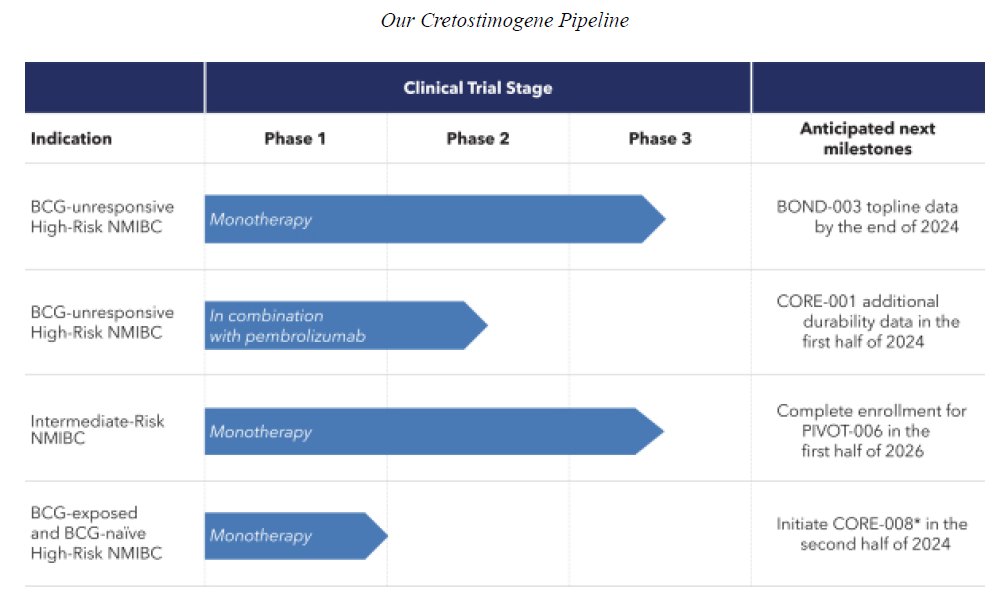
图2 Cretostimogene的临床试验
图片来源:参考文献2
BOND-003是一项评估Cretostimogene单药治疗BCG无反应的高危NMIBC的试验。2023年11月份,CG Oncology公布了BOND-003试验的中期数据:截至2023年10月5日,66名患者中有50名患者达到完全缓解(CR),完全缓解率为75.7%,维持6个月以上完全缓解率为74.4%(图3)[3]。
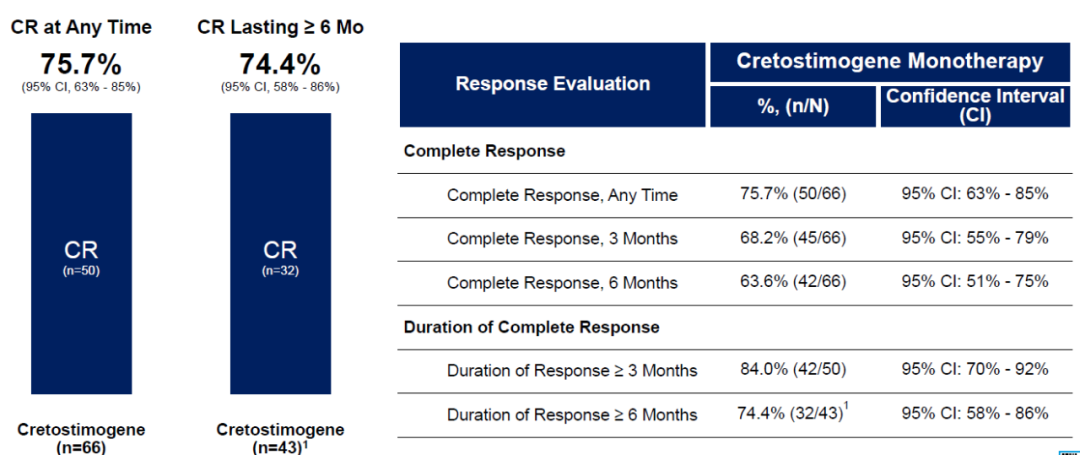
图3 BOND-003试验的中期结果
图片来源:参考文献3
Cretostimogene单药治疗持续响应,74%的患者至少维持6个月以上的完全缓解,31%的不响应患者在第二个诱导治疗期内产生治疗响应(图4)。
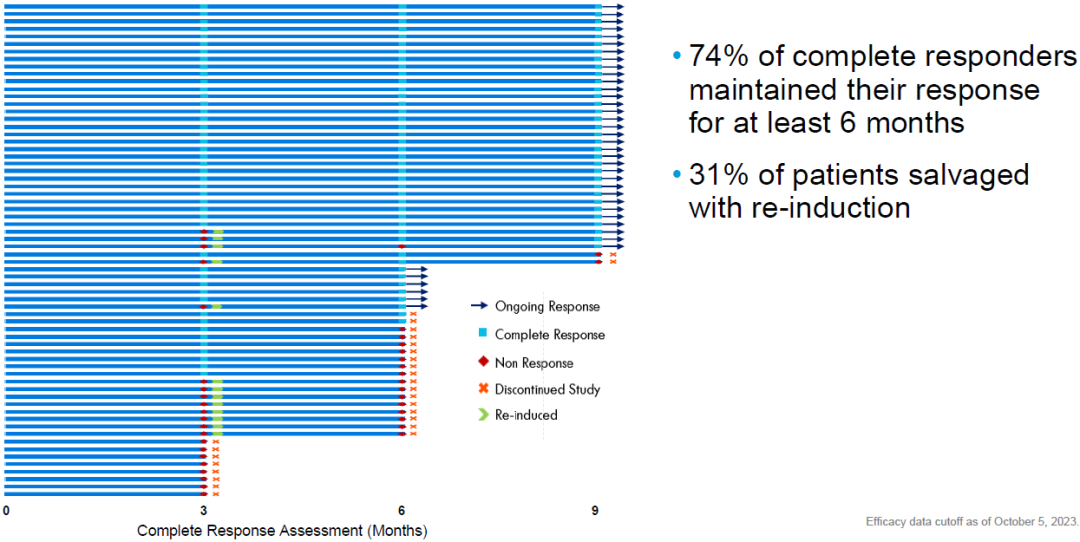
图4 Cretostimogene随时间推移显示出持久的反应
图片来源:参考文献3
Cretostimogene联合PD-1抗体Pembrolizumab治疗则进一步提升疗效,34名患者中有29名达到完全缓解,完全缓解率为85%。安全性方面,也是唯一没有3级及以上副作用的创新疗法(图5)。
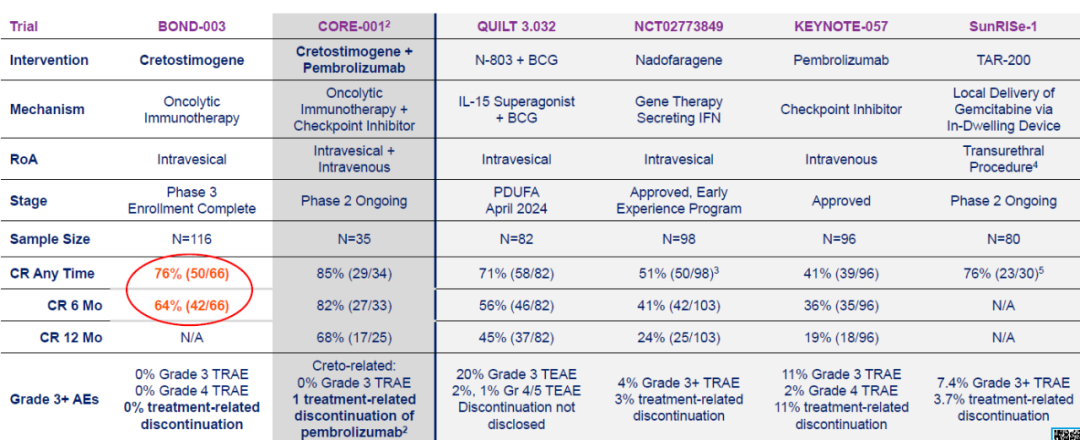
图5 BOND-003和CORE-001的试验结果
图片来源:参考文献3
该项试验还在继续进行,预计将于2024年底报告顶线数据。如果成功,CG Oncology将以该试验结果为基础向FDA提交Cretostimogene的生物制品许可申请(BLA)。
凭借优异的疗效与安全性,Cretostimogene已于2023年12月份被FDA授予Cretostimogene快速通道资格(FTD)和突破性疗法认定,用于治疗高危、卡介苗治疗不响应NMIBC患者[4]。
值得注意的是,2019年3月,乐普生物引进CG0070的大中华区权益。乐普生物同时手握已上市的PD-1抗体普特利单抗可以形成互补,联合治疗NMIBC进一步提升疗效。
02
3期临床众多,
溶瘤病毒药物全球在研分析
溶瘤病毒(OVs)是一类能够特异性复制并引起癌细胞凋亡,同时保留正常组织不被破坏的病毒,溶瘤病毒疗法(OVT)是一种备受关注的新型肿瘤免疫治疗手段,具有“免疫治疗”、“靶向治疗”、“基因治疗”三合一的特点,有望成为新一代抗癌利器。
溶瘤病毒感染肿瘤细胞后可在宿主细胞内复制,释放的子代病毒可以继续感染周围的肿瘤细胞,同时激活局部或全身抗肿瘤免疫效应,改变肿瘤微环境,进一步提高抗肿瘤效应(图6)。
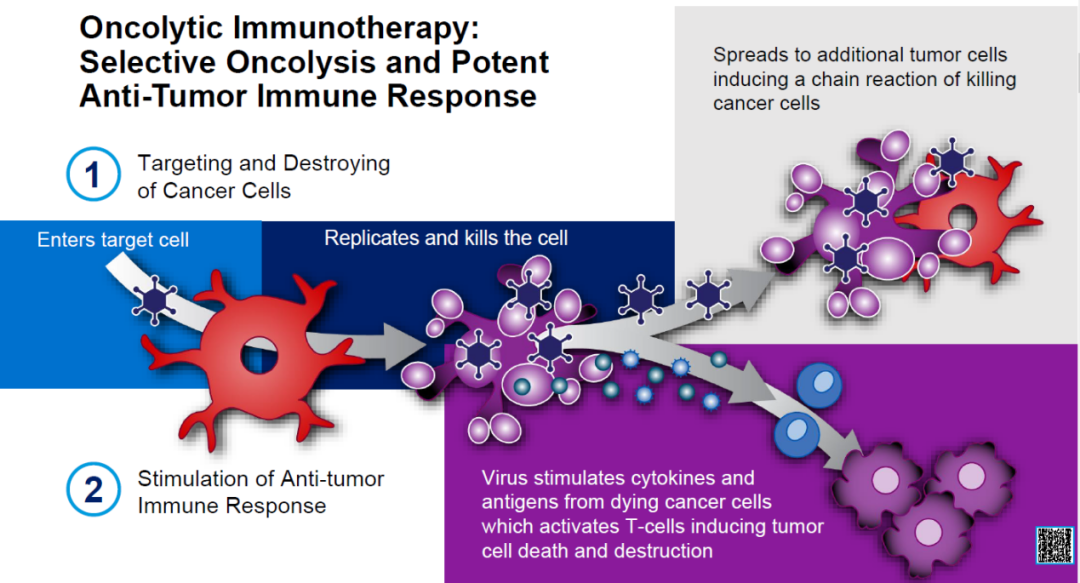
图6 溶瘤病毒疗法作用机制
图片来源:参考文献3
虽然早在20世纪初就发现溶瘤病毒,但是直到2015年美国FDA首次批准安进的用于治疗黑色素瘤的溶瘤病毒疗法Imlygic,溶瘤病毒疗法研发才缓慢步入正轨。
据不完全统计,全球曾批准过5款溶瘤病毒疗法,国内外多家公司加入布局,如Icell Kealex Therapeutics、Cell Genesys、Virogin Biotech、滨会生物、复诺健、亦诺微、威溶特和康万达等,临床在研的溶瘤病毒疗法有多种(表1)。
表1 部分在研的溶瘤病毒疗法
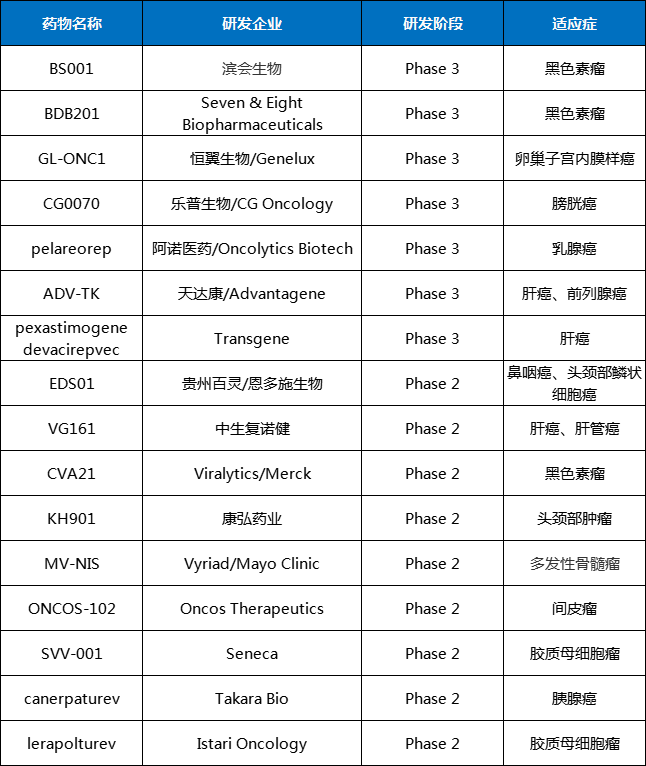
数据来源:药智数据、各大公司官网
BS001是由滨会生物自主研发的全球第一个选择Ⅱ型单纯疱疹病毒(HSV2)作为载体,并进入临床试验的溶瘤病毒候选药物,其用于治疗黑色素瘤的试验已进入临床3期,与此同时滨会生物在中美同时开展BS001的临床试验(图7)。
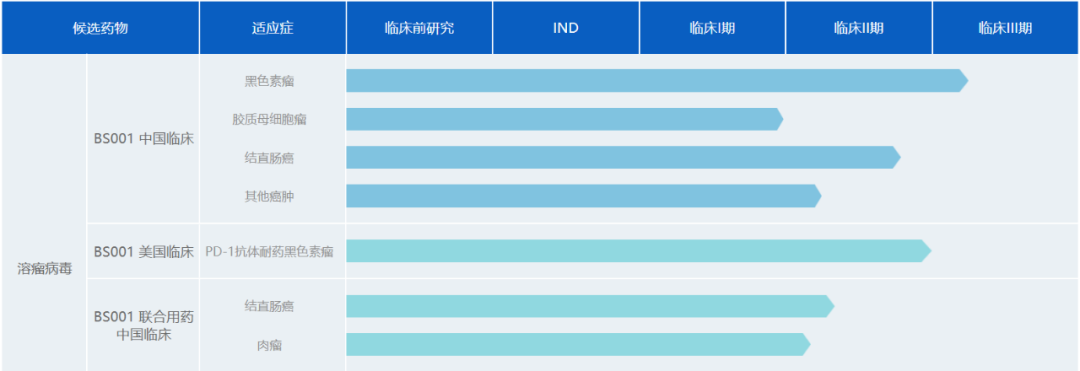
图7 BS001的临床试验
图片来源:滨会生物官网
2022年7月,BS001注射液获美国FDA孤儿药认定,用于治疗IIb期至IV期黑色素瘤,是首 个中国自主研发获得美国FDA孤儿药认证的溶瘤病毒候选药物;2023年2月CDE将OH2注射液纳入突破性治疗品种;2023年6月被FDA授予快速通道资格(FTD)资格,用于治疗抗PD-1治疗后耐药或进展的不可切除的Ⅲ期或IV期黑色素瘤[4]。
此前,在北京大学肿瘤医院开展的临床试验中显示,BS001注射液治疗接受PD-1治疗失败且疾病分期为III-IVM1a的亚组人群的ORR高达62.5%,总体生存期(OS)显著延长[4]。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57