一
月度总结
按药渡数据统计分析,2024年1月份药品审评中心(CDE)共承办1441个药品注册申请(按受理号计算),本月相比上月共减少了120个受理号,中药减少62个,生物药减少23个,化学药减少33个,体外诊断试剂减少2个。
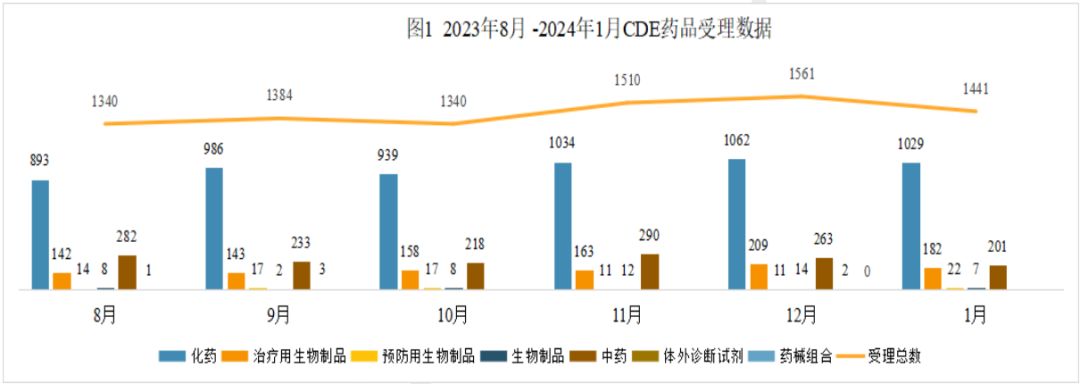
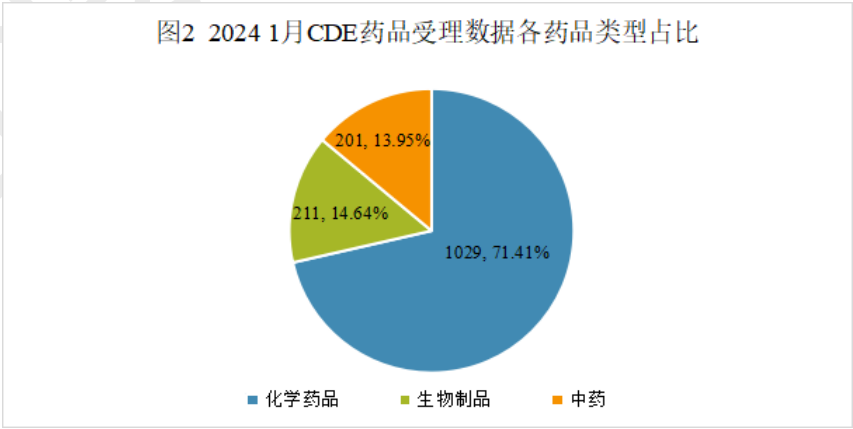
其中化学药品约占比71.4%,生物药约占比14.6%,中药约占比14.0%。
二
化药审评情况
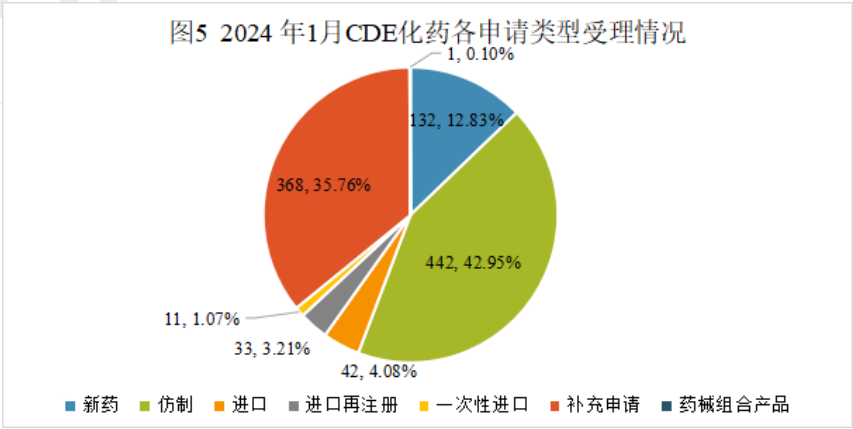
2024年1月份CDE共承办化药注册申请1029个(按受理号计算)。
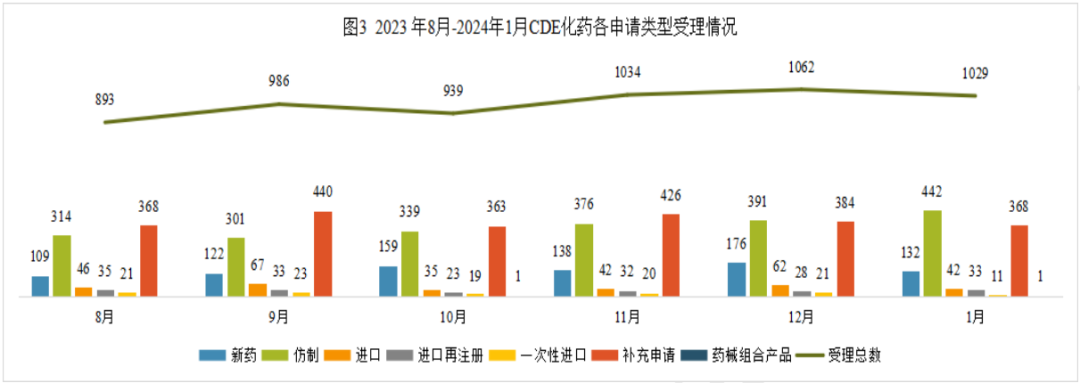
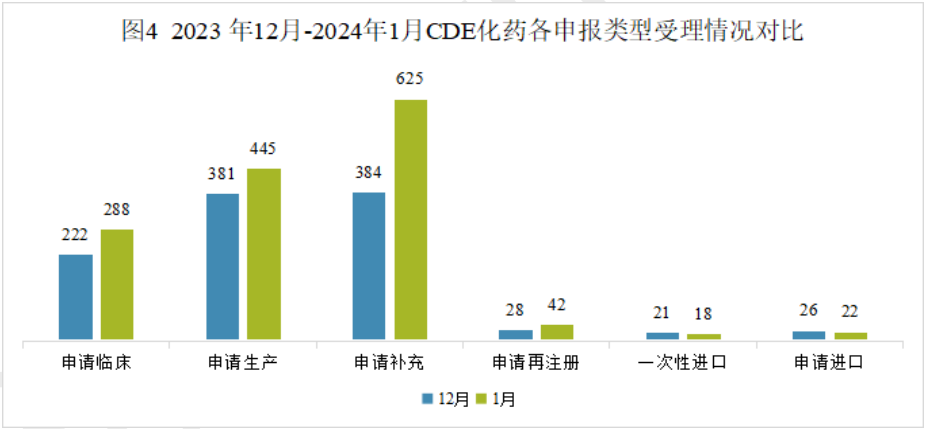
1月份化药申请临床288个,申请生产445个,申请补充625个,申请再注册42个,相比上年12月份申报数量是增长的;一次性进口和申请进口的申报数量则比上年12月份要少。
1
国产化药注册1类申报情况
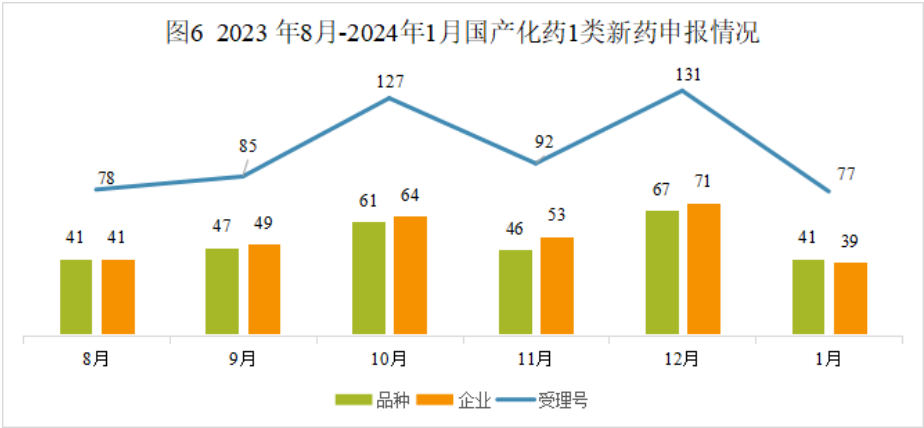
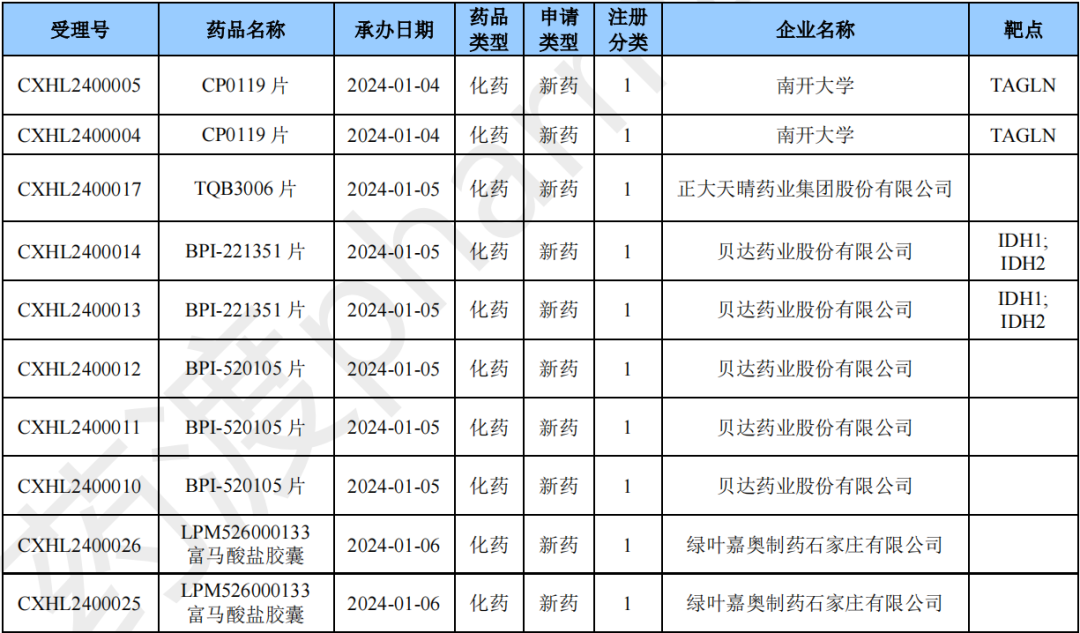
本月CDE受理国产化药注册1类新药共计77个受理号,涉及41个品种和39家企业。
2024年1月国产化药1类新药(部分)
甲磺酸瑞齐替尼胶囊
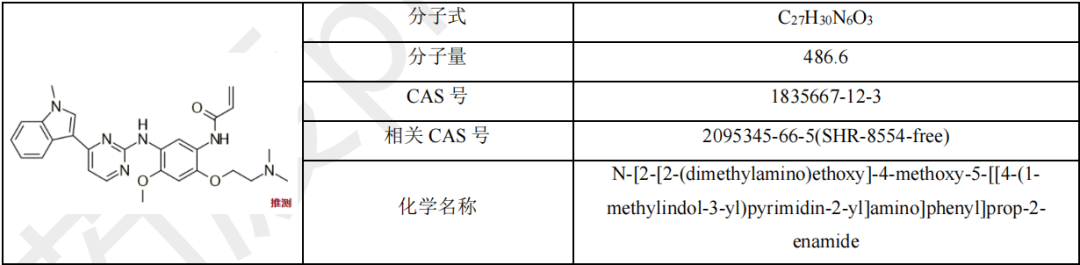
瑞泽替尼(瑞齐替尼,BPI-7711)是由上海倍而达药业有限公司研发的一种小分子药物,是一种EGFR T790M抑制剂。该药为中国化药一类。目前该药物最高研发阶段为申请上市,用于治疗非小细胞肺癌。
医药交易
2021年3月9日,石药(上海)有限公司与上海倍而达药业有限公司就BPI-7711订立产品授权及商业化协议。石药上海将获得BPI-7711胶囊的独家权利,以于中华人民共和国(包括香港特别行政区和澳门特别行政区,但不包括台湾地区)进行BPI-7711胶囊的商业化活动,并拥有BPI-1178胶囊(CDK4/6抑制剂)商业化授权的优先谈判权。与此同时,石药集团同意向倍而达药业方面进行股权认购,首次认购金额人民币2亿元。(https://www1.hkexnews.hk/listedco/listconews/sehk/2021/0309/2021030901405_c.pdf)
研发里程碑
2021年05月07日,由上海倍而达药业有限公司向中国国家药品监督管理局NMPA提交上市申请,用于治疗非小细胞肺癌。(CXHS2101009)
2021年04月30日,由上海倍而达药业有限公司在中国大陆开展临床三期试验,用于治疗非小细胞肺癌。(CTR20190442; NCT03866499)
2021年03月09日,由石药集团有限公司开展临床前研究试验。(https://www1.hkexnews.hk/listedco/listconews/sehk/2021/0309/2021030901405_c.pdf)
2019年12月17日,由上海倍而达药业有限公司在中国大陆开展临床一期试验,用于治疗非小细胞肺癌。(CTR20192158; CTR20170388; CTR20192160; CTR20192519)
2019年12月12日,由Beta Pharma Inc在中国大陆开展临床一期试验,用于治疗非小细胞肺癌。(NCT04135833; NCT04135820)
2017年08月16日,由上海倍而达药业有限公司在中国大陆开展临床二期试验,用于治疗非小细胞肺癌。(CTR20190214; NCT03812809; NCT03386955)
2
进口化药注册1类申报情况
本月CDE受理进口化药注册1类新药共计21个受理号,涉及8个品种和16家企业。
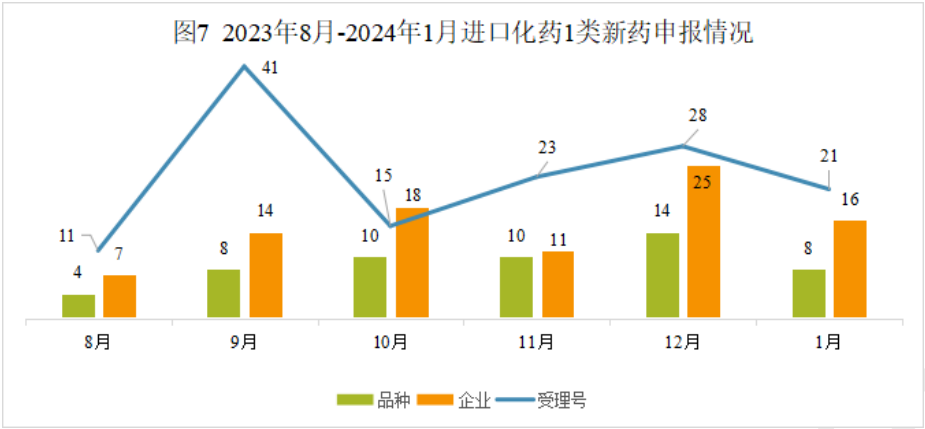
2024年1月进口化药1类新药(部分)
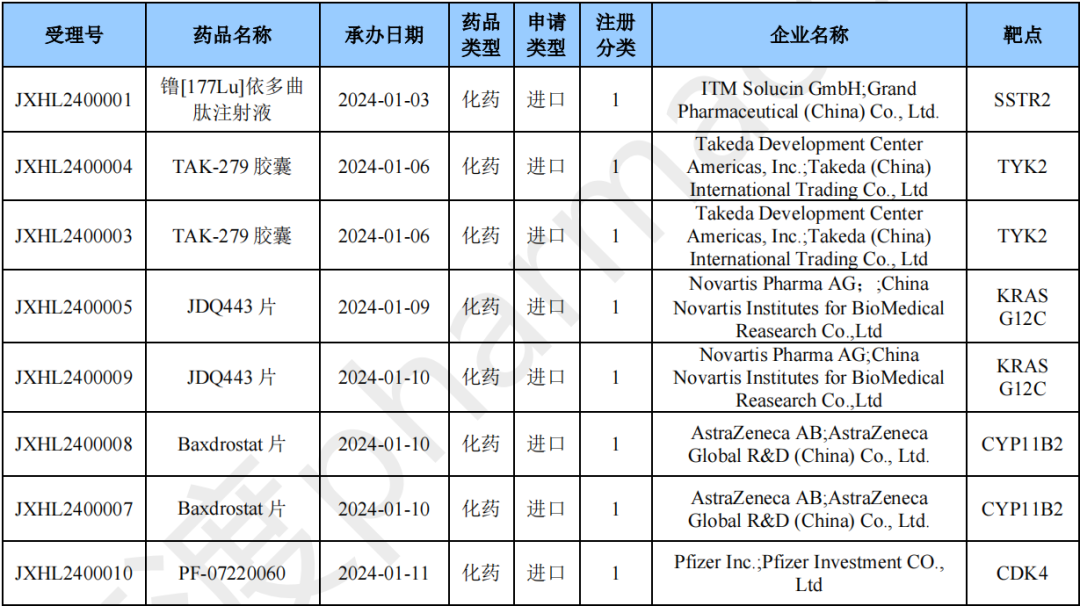
Ulixacaltamide缓释片
Ulixacaltamide是由Zalicus Inc研发的一种小分子药物,是一种T-channels阻滞剂。目前该药物最高研发阶段为临床三期,用于治疗特发性震颤。
医药交易
2024年1月8日,元羿生物科技(上海)有限公司与Praxis Precision Medicines Inc达成独家合作和许可协议。元羿生物将在大中华地区开发并商业化治疗原发性震颤的 Ulixacaltamide,作为合作协议的一部分,Praxis 将获得1500万美元的首付款,其中包括500万美元现金和 1000 万美元的普通股投资。此外,Praxis 预计将获得 2.64 亿美元的开发、监管和商业化里程碑付款,以及大中华地区净销售额的分级特许权使用费。(https://mp.weixin.qq.com/s/Q_nericOtwBT0qDkOY_hTA)
研发里程碑
2024年01月31日,由Praxis Precision Medicines向中国国家药品监督管理局NMPA提交IND申请。(JXHL2400026; JXHL2400025; JXHL2400024)
2024年01月08日,由Tenacia Biotechnology (Shanghai) Co Ltd开展临床前研究试验。(https://mp.weixin.qq.com/s/Q_nericOtwBT0qDkOY_hTA)
2023年11月02日,由Praxis Precision Medicines在美国开展临床三期试验,用于治疗特发性震颤。(NCT06087276)
2021年10月14日,由Praxis Precision Medicines在加拿大开展临床二期试验,用于治疗特发性震颤。(NCT05021991)
2020年03月03日,由Praxis Precision Medicines在澳大利亚、新西兰和美国等国家和地区开展临床二期试验,用于治疗特发性震颤。(NCT05021978; NCT05021991)
3
化药注册2类申报情况
本月CDE受理化药注册2类改良型新药共计61个受理号,涉及39个品种和45家企业。
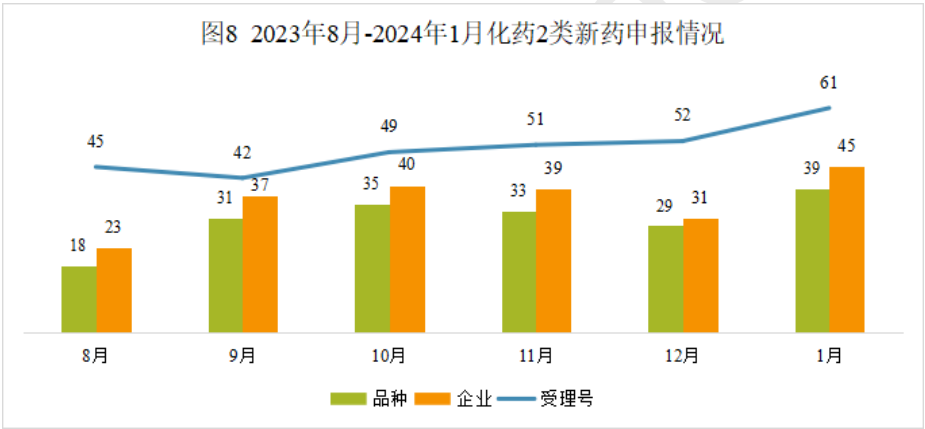
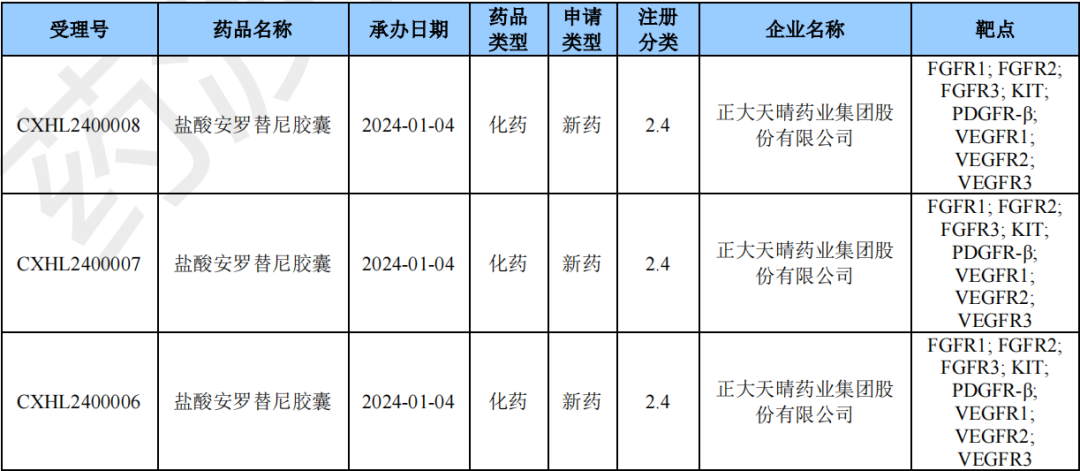
2024年1月化药注册2类新药(部分)
三
生物制品审评情况
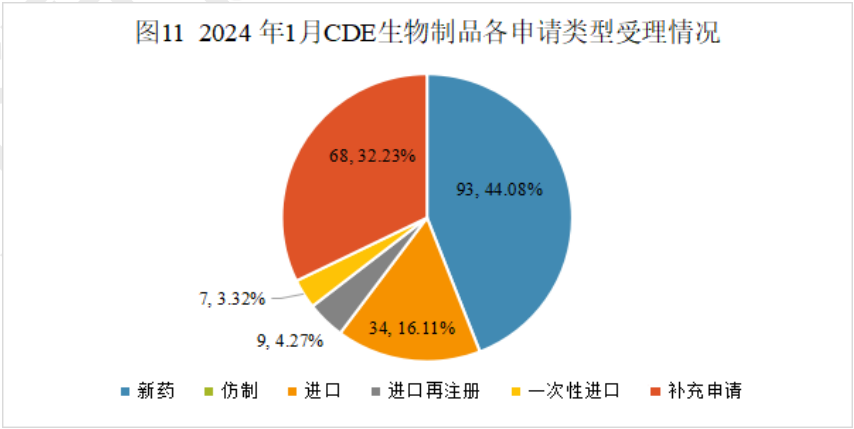
2024年1月份CDE共承办生物制品注册申请211个(按受理号计算)。
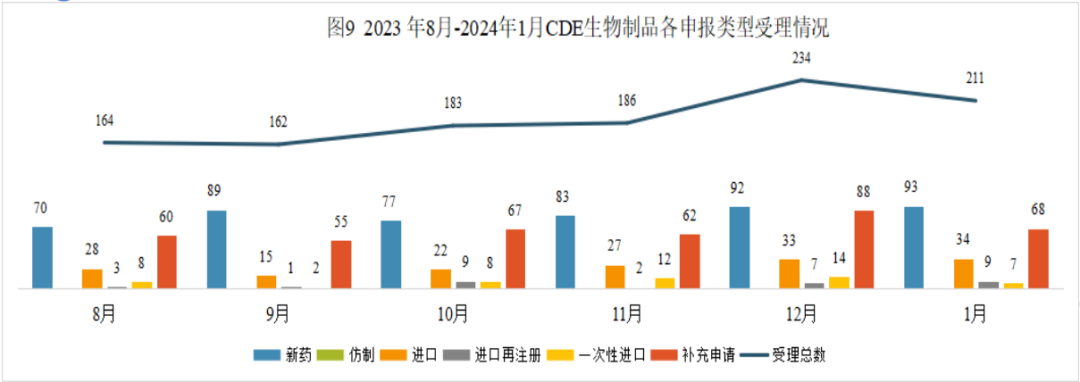
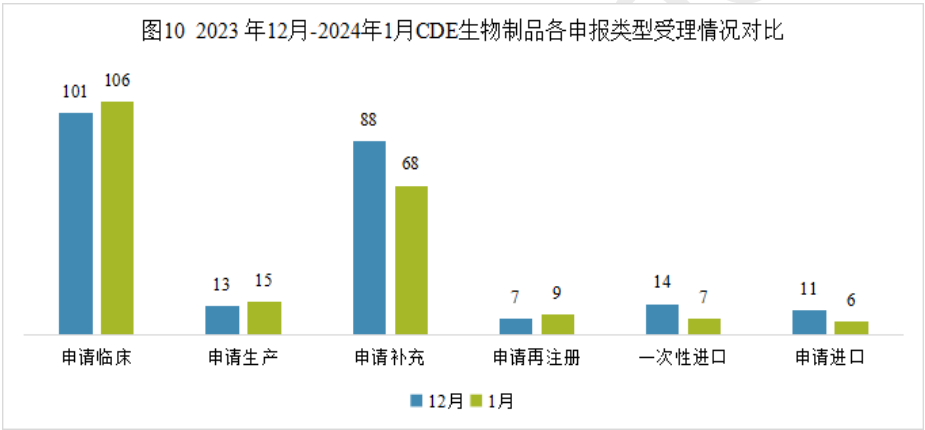
1月份生物药申请生产15个、申请临床106个、申请再注册9个,与上年12月份申报数量相比略有增多;申请补充、一次性进口和申请进口的申报数量则比上年12月份要少。
1
国产生物制品注册1类申报情况
本月CDE受理国产生物制品注册1类新药共计65个受理号,涉及55个品种和55家企业。
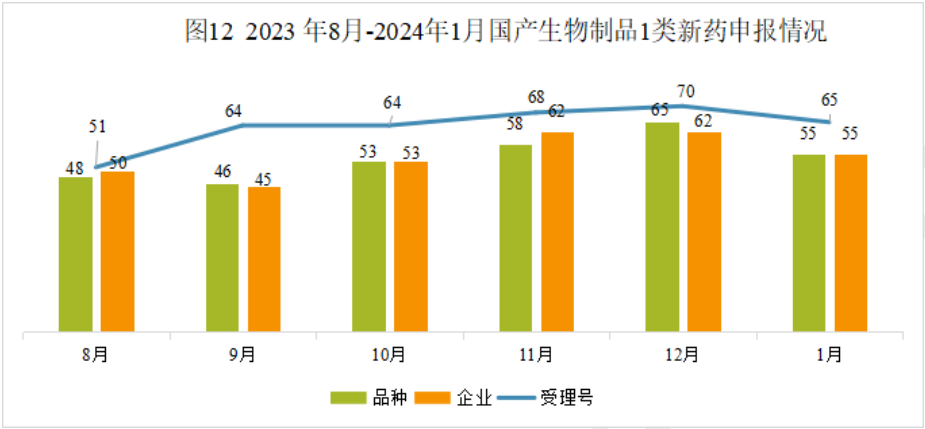
2024年1月国产生物制品1类新药(部分)
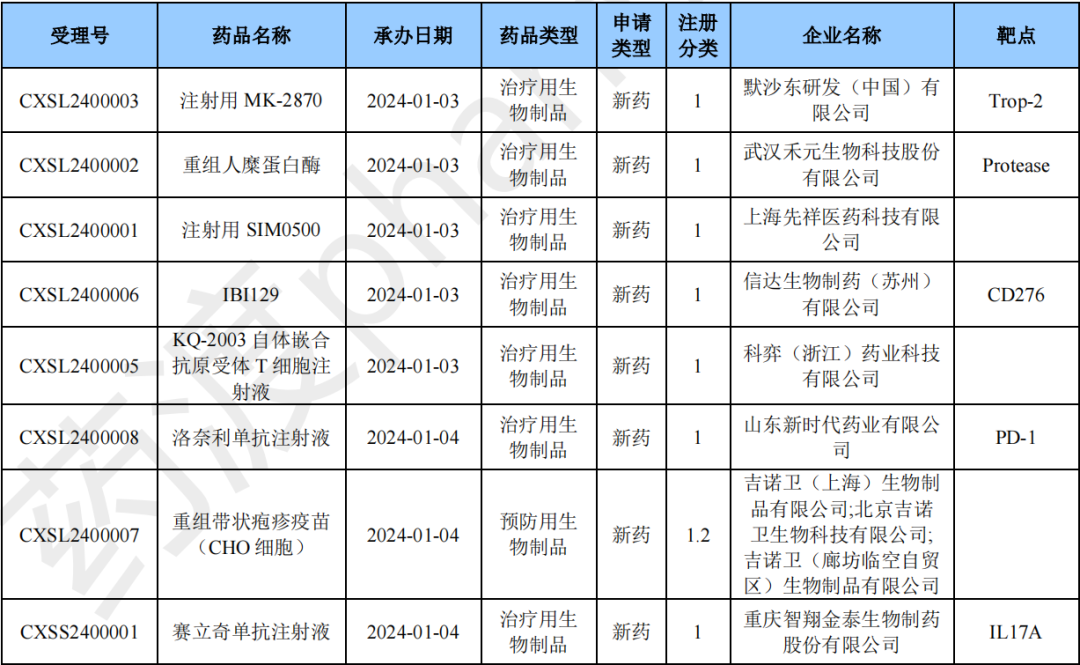
怡培生长 激素注射液
怡培生长 激素是由厦门特宝生物工程股份有限公司研发的一种重组激素,是一种GHR激动剂。该药为中国生物药一类。目前该药物最高研发阶段为申请上市,拟用于治疗内源性生长 激素分泌不足所致的儿童生长障碍。
II/III期研究(n=43)结果显示,儿童生长 激素缺乏症(GHD)患者接受12周的治疗后,怡培生长 激素100、120、140μg/kg/周组和重组人生长 激素35μg/kg/天组(对照组)的身高增长速度分别为7.07、10.39、12.27厘米/年和11.58厘米/年。(https://pubmed.ncbi.nlm.nih.gov/36034448/)
研发里程碑
2024年01月11日,由厦门特宝生物工程股份有限公司向中国国家药品监督管理局NMPA提交上市申请,用于治疗生长障碍。(CXSS2400004;CXSS2400005;CXSS2400006;CXSS2400007;CXSS2400008)
2019年05月06日,由厦门伯赛基因转录技术有限公司和厦门特宝生物工程股份有限公司在中国大陆开展临床三期试验,用于治疗生长障碍。(CTR20190901)
2014年08月01日,由厦门伯赛基因转录技术有限公司和厦门特宝生物工程股份有限公司在中国大陆开展临床一期试验。(CTR20140394)
2012年08月16日,临床一期研究暂无进展。(CTR20140394)
2008年02月26日,由厦门伯赛基因转录技术有限公司和厦门特宝生物工程股份有限公司向中国国家药品监督管理局NMPA提交IND申请,用于治疗生长 激素缺乏,为中国生物药一类。(CXSL0800002)
2
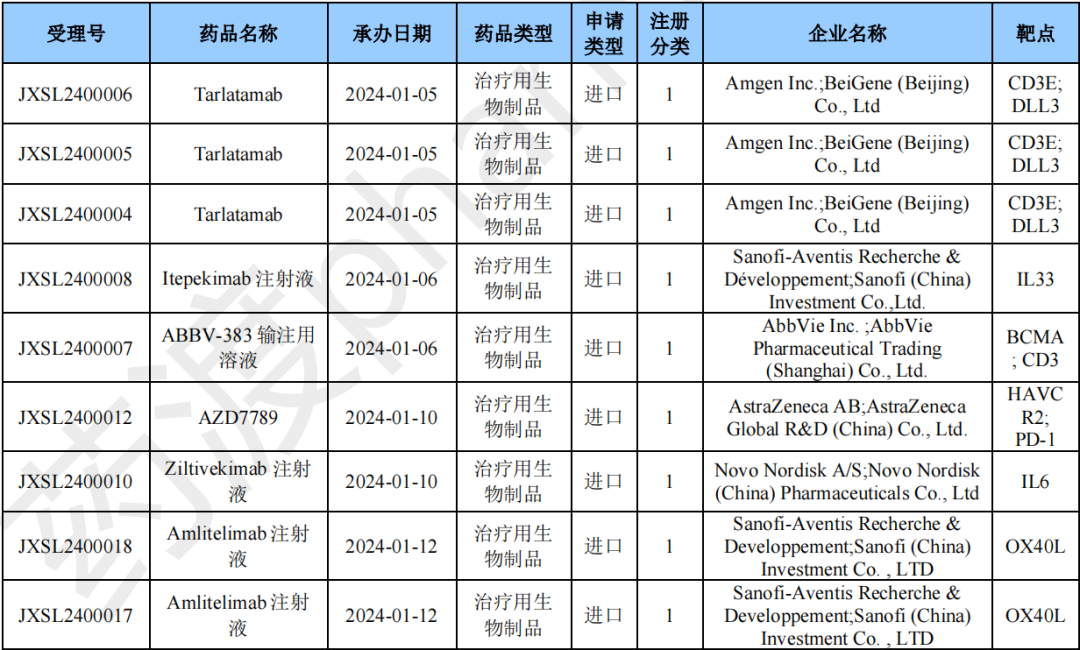
进口生物制品注册1类申报情况
本月CDE受理进口生物制品注册1类新药共计19个受理号。涉及9个品种和16家企业。
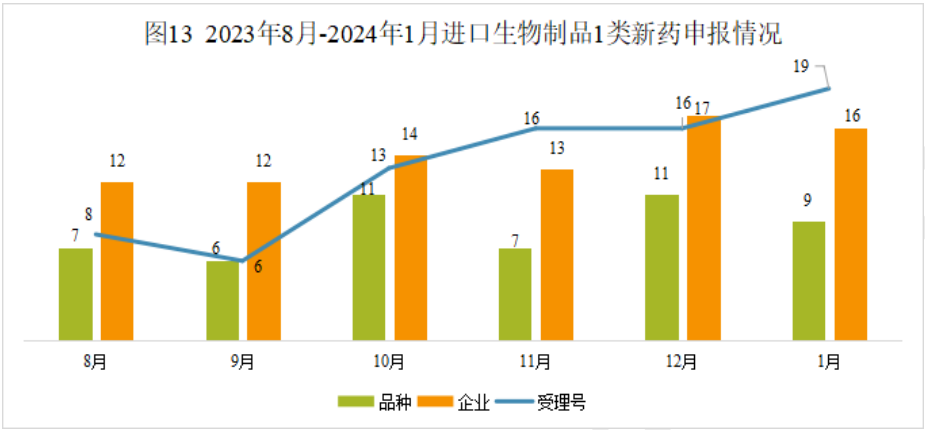
2024年1月进口生物制品1类新药(部分)
3
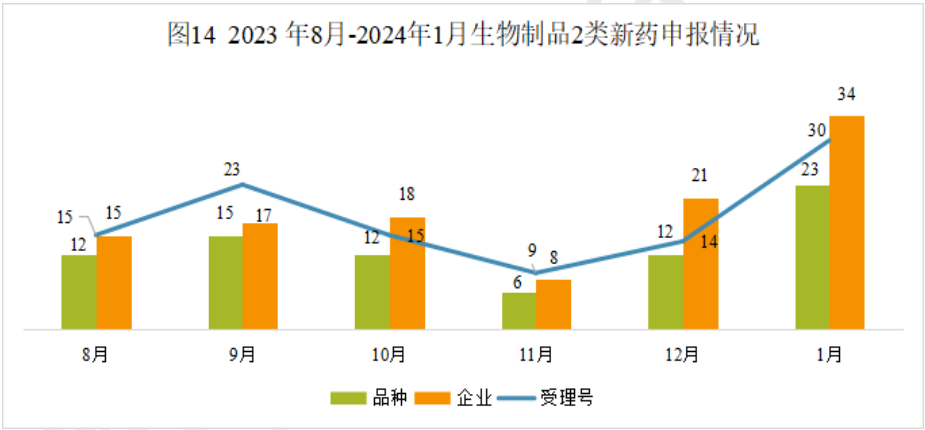
生物制品注册2类申报情况
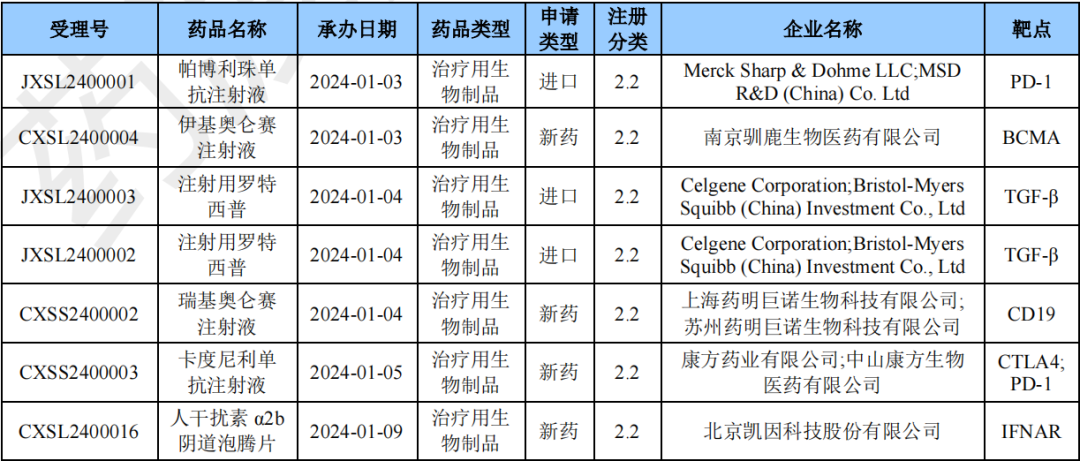
本月CDE受理生物制品注册2类改良型新药共计30个受理号,涉及23个品种和34家企业。
2024年1月生物制品2类新药(部分)
4
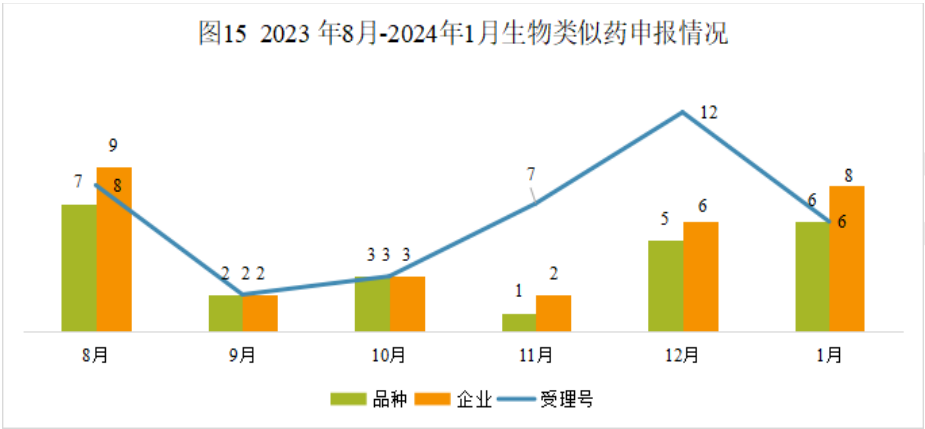
生物类似药申报情况
本月CDE受理生物类似药共计6个受理号,涉及6个品种和8家企业。
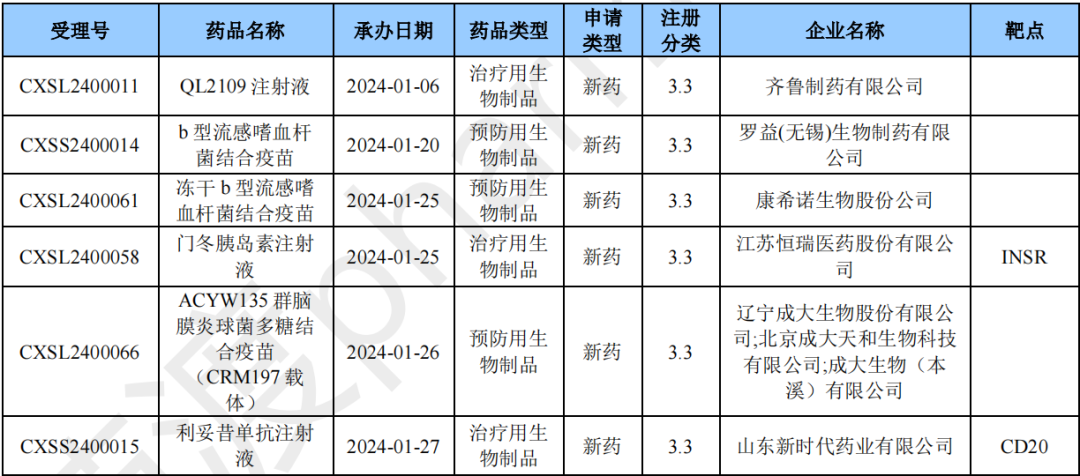
2024年1月生物类似药
四
中药审评情况
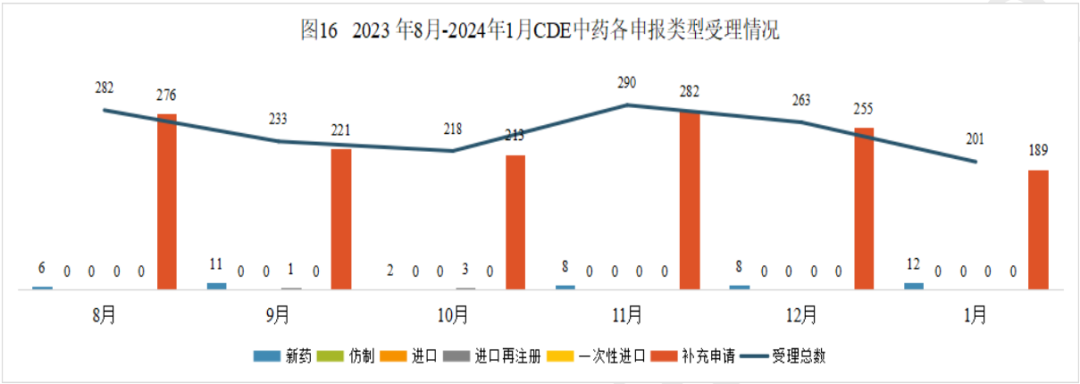
2024年1月份CDE共承办中药注册申请201个(按受理号计算)。
中药注册药申报情况
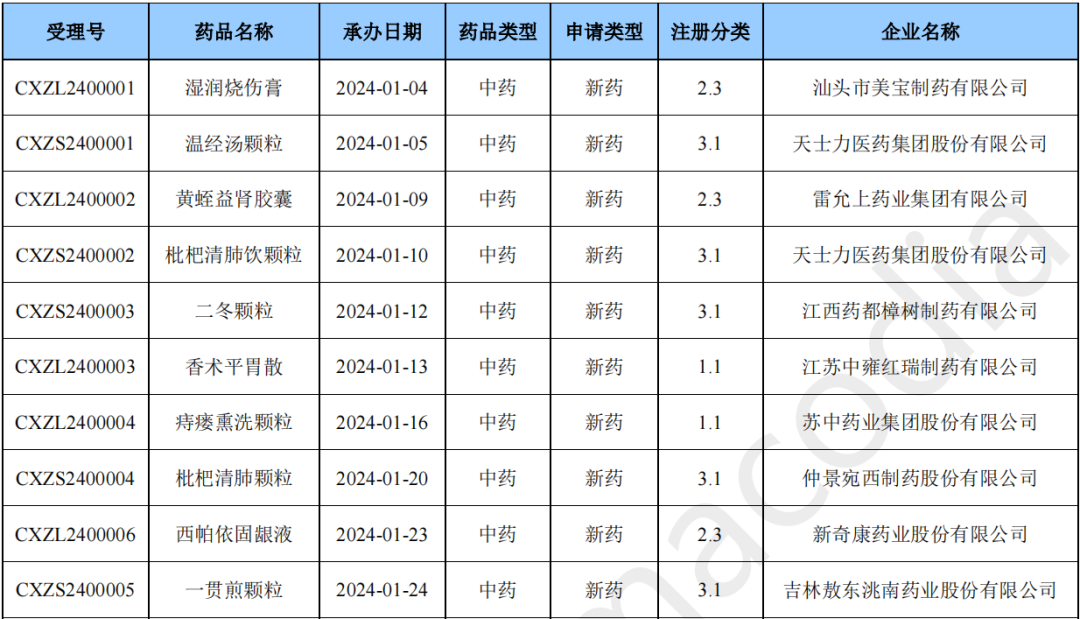
本月CDE受理中药注册新药共计12个受理号,涉及12个品种和12家企业。
2024年1月中药新药(部分)
五
按一致性评价申报品种情况
本月新增85个按一致性评价要求进行申报的受理号。
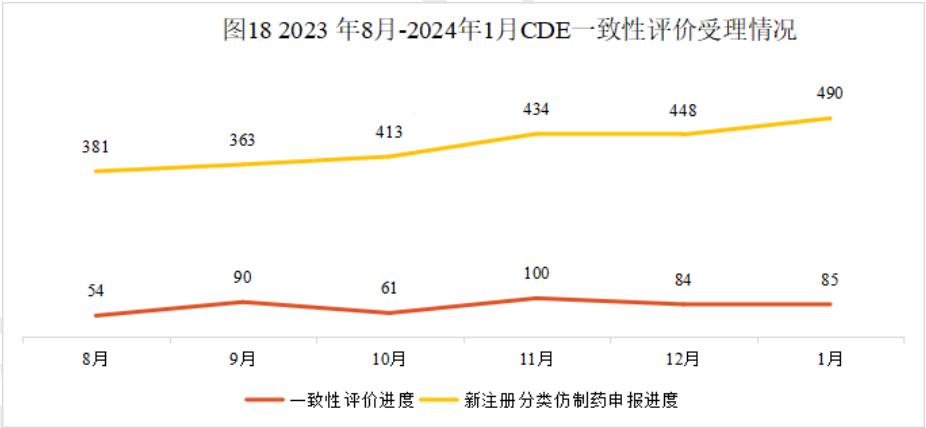
2024年1月CDE一致性评价受理情况(部分)



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57