肽核酸(PNA,Peptide Nucleic Acid)是一种人工合成的类似于DNA或RNA的聚合物。PNA可以说是诞生在丹麦的化合物,它最初由 Peter E. Nielsen(哥本哈根大学)、Michael Egholm(哥本哈根大学)、Rolf H. Berg(Risø国家实验室,丹麦科技大学)和 Ole Buchardt(哥本哈根大学)于 1991 年发明。
1
PNA的化学结构
DNA 和 RNA 的分子骨架是由交替的核糖(脱氧核糖)和磷酸通过磷酸二酯键连接在一起的。与核酸不同,PNA的主链是由重复 N-(2-氨基乙基)-甘氨酸单元(图1)通过肽键(酰胺键)搭建而成的(图2 蓝色部分)。相同的是,它们都包含有侧链的核碱基(nucleobase)。在PNA分子中,各种嘌呤和嘧啶碱基(图2红色部分)通过乙酰结构(图2绿色部分)与主链上甘氨酸部分的N融合。
可以说PNA结合了两个截然不同的大分子特征:肽和核酸。从整体来看,PNA像是包含碱基侧链的聚N-(2-氨基乙基)-甘氨酸多肽。
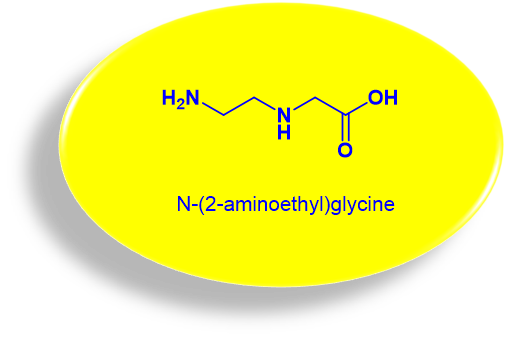
图1. N-(2-氨基乙基)-甘氨酸化学结构
如果碱基序列互补,则PNA可以与 DNA 链之间产生结合作用。PNA 侧链的碱基可以与双链RNA或DNA双螺旋主沟的碱基之间形成氢键,从而与双链 RNA 或 DNA 的外部结合。这种所谓的 Hoogsteen 配对产生了三重螺旋。由于 PNA 的主链不包含带负电的磷酸二酯基团,因此由于缺乏静电排斥,因此PNA与DNA 链之间的结合比 DNA与DNA 链之间的结合更强。PNA甚至还可以破坏DNA双链之间的结合,从而插入DNA双链中间。但缺少电荷的事实也使PNA相当疏水,这使得它很难以溶液形式输送到体细胞。
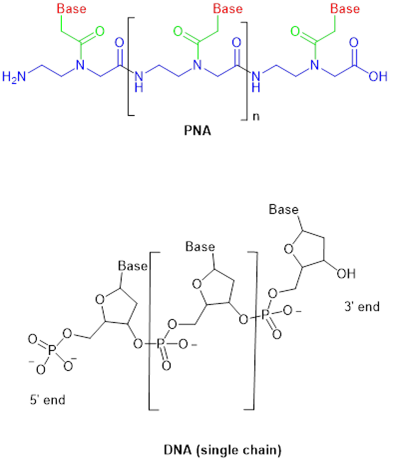
图2. PNA与DNA (单链) 化学结构。
PNA的化学修饰
PNA的特性使得这类化合物成为反义药物的理想选择,因为PNA可以通过结合 mRNA 来抑制蛋白质的产生。从理论上讲,PNA 可以比当今开发的大多数反义药物(通常是 DNA 或 RNA 片段)结合得更牢固。
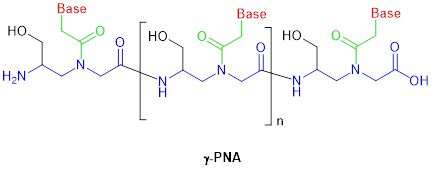
图3. γ-PNA化学结构
第一代 PNA 不溶于水,因此这些分子很容易在溶液中聚集,并与细胞中的其他生物聚合物产生非特异性结合,从而导致毒性。这一问题通过γ-PNA的分子设计得到了解决。通过将羟甲基引入PNA主链上N-(2-氨基乙基)-甘氨酸单元上的Cγ(图3)。修饰后的 γ-PNA与DNA 和 RNA 更有效地结合。与未修饰的 PNA相比,γ-PNA 与DNA的结合更加稳定。除此之外,PNA不会像合成 DNA 或 RNA 那样被核酸酶和蛋白酶降解,这种特性赋予它们更好的稳定性。除了羟甲基之外,研究人员还在在肽骨架上添加二甘醇侧链,以此增加 PNA 的结合强度并增加改性PNA的溶解度。这些化学修饰PNA可以解决PNA候选药物递送至靶细胞的问题。
2
PNA的应用
PNA的应用包括改变基因表达,可以作为抑制剂和启动子、反基因和反义治疗剂、抗癌剂、抗病毒剂、抗菌剂和抗寄生虫剂、生物传感器的分子工具和探针、DNA 序列检测和纳米技术。
基因组编辑
2022 年 10 月,Neubase将其 PNA 业务的重点转向基因编辑上。Neubase 与一家全球医疗保健公司合作,计划创建 PNA,旨在编辑三种未公开疾病的基因突变。异常的核酸结构是内源性修复的关键,可能发生在序列特定的条件下。PNA能够实现非酶促基因编辑。该方法利用了 Nielson 于 1991 年发现的 PNA 侵入和撬开双链 DNA 分子的能力。通过在基因组内形成高亲和力的异源双链或三链体结构,PNA 已被用于纠正多种人类疾病相关突变,且脱靶效应较低。分子设计、化学修饰和递送方面的进步使 PNA 的系统性体内应用成为可能,从而在临床前小鼠模型中实现基因编辑。在 β-地中海贫血模型中,经过治疗的动物表现出临床相关的蛋白质恢复和疾病表型改善,表明 PNA 具有治疗性应用治疗单基因疾病的潜力。
核酸传感
特定核酸序列的检测在生物医学研究和诊断中至关重要。PNA 独特的杂交特性和代谢稳定性使其非常适合在复杂的生物环境甚至整个细胞中进行传感。 活细胞成像的主要策略之一是使用荧光探针,并在双链体复合物形成时增加荧光。这一技术已经应用于检测 KRAS 致癌突变 (SNP)。荧光PNA 探针的用途也已扩展到三链体的检测。
超分子药物
在过去十年中,许多研究使用 PNA―配体偶联物,将其自组装为更大的结构。已发现 PNA―配体偶联物的组装体在体内具有活性功能。 例如靶向 αvβ3 整合素(一种在许多癌症中过度表达的三聚体受体)的 PNA―配体偶联物在寡聚化时显示出 100 倍的增强结合,导致小鼠模型中的肿瘤集落减少 50%。PNA 标记的大分子已被用于编程抗体片段 (Fab),以快速探索双特异性抗体。
反义治疗剂
PNA 的代谢稳定性和强结合亲和力使其成为反基因治疗的可利用工具。PNA 是空间阻滞剂,通过与起始位点结合来抑制靶 mRNA 的剪接或翻译。在 C 末端用四个赖氨酸修饰的 PNA分子,被证实可有效纠正转基因小鼠的异常剪接,显示出其作为治疗剂的潜力。 在另一项研究中,GPNA(α-胍基修饰PNAs) 成功地用于抑制小鼠模型中 EGFR 的表达,EGFR 是非小细胞肺癌的重要驱动因素。
PNA治疗剂
PNA 的主要候选药物使用直接的反义方法。韩国制药公司 OliPass在这方面具有领先优势,其最 先进的候选药物止痛药 OLP-1002 正在进行临床试验。Olipass 的 PNA 用含有阳离子脂质基团的碱基进行修饰,可提高稳定性并易于进入细胞。这使得它们在低至 10 ng/kg 的剂量下在动物模型中具有活性,比现有的反义寡核苷酸低许多数量级。 PNA 可以进入细胞核,并与前体 mRNA 相互作用。前体 mRNA 是在剪接酶切除不需要的部分之前,通过转录产生的第一个 mRNA 版本。通过与这些前体mRNA 分子结合,PNA 从根本上防止剪接酶清理 RNA 代码,导致 mRNA 无法正确翻译,从而阻止蛋白质生产。
第二家利用 PNA 技术的公司是总部位于匹兹堡的 Neubase Therapeutics。该公司目前拥有针对三种疾病的 PNA 候选药物。他们最 先进的候选药物 NT-0200 针对 1 型强直性肌营养不良症,这是一种由错误的 RNA 引起的进行性肌肉疾病,它会捕获关键的剪接蛋白并导致细胞翻译错误。根据 Neubase 的小鼠研究,NT-0200 可恢复广泛组织的下游蛋白质生产。该公司还有一种 PNA 候选药物,它在转录成 mRNA 后靶向亨廷顿基因的重复三核苷酸序列。
3
总结
几种 PNA 药物正在进行临床试验,其他药物正在开发中。开发可行的 PNA 疗法的道路一直很艰难。学术界和初创企业的科学家们对 PNA 骨架的化学调整,使分子更容易潜入细胞并更牢固地锁定 RNA 以沉默基因。在开发这些疗法的同时,化学家现在能够利用 PNA 嵌入DNA 螺旋的能力,使其成为基因编辑的理想工具,并成为突破性 CRISPR-Cas9 系统的潜在替代品。尽管 CRISPR 有十年的领先优势,但现在有几种使用 PNA 的基因编辑方法正在研究开发之中。虽然PNA的技术目前可以说尚未修成正果,但距离它们正式登上医药舞台的时间应该不会太远了。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57