ADC作为新一代抗肿瘤神药,成为各大药企的“必争之地”。恒瑞医药作为国内创新药企龙头,自然也不会错过ADC。
实际上,早在2011年恒瑞就通过仿造罗氏HER-2 ADC药物T-DM1,开发了其第一款ADC药物SHR-A1201,并在2013年推进至临床,不过近几年这款产品已消失在恒瑞的在研管线列表中。
今年的JPM大会上,恒瑞首席战略官江宁军公布了新一年的布局重点。他表示,ADC为恒瑞医药在肿瘤领域最为重要的布局。基于10年的ADC研发经验,恒瑞打造了模块化HRMAP技术平台,可快速开发各种差异化的ADC产品。
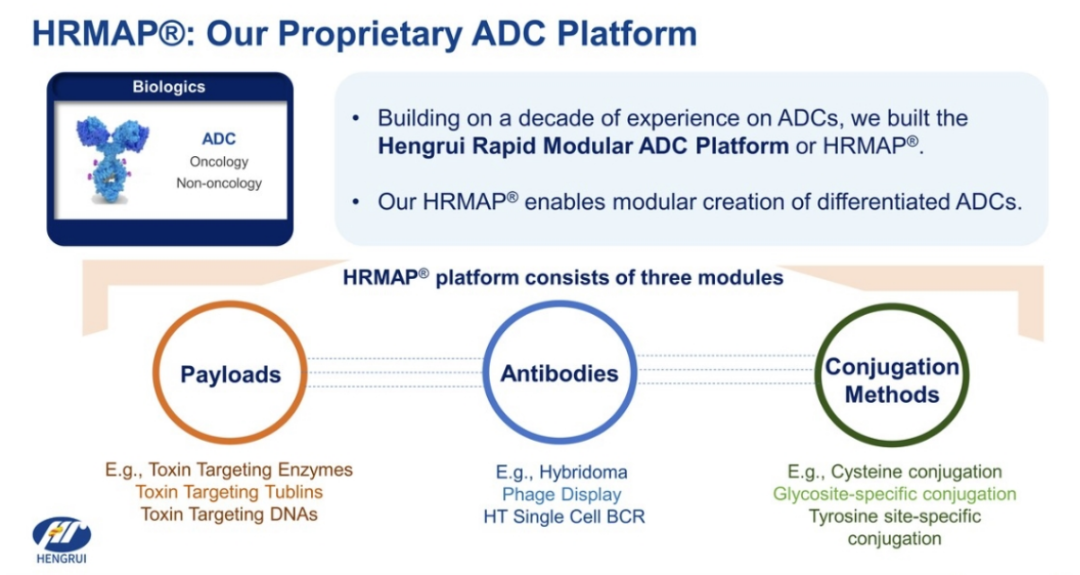
图片来源:恒瑞JPM2024 PPT
经过多年发展,恒瑞医药的 ADC 技术平台已逐步进入收获期。在最新公布PPT中,恒瑞有40个肿瘤管线,其中8个临床阶段ADC管线。

图片来源:恒瑞JPM2024 PPT
除了这8个临床阶段ADC,恒瑞在其他时间还曾公布过多个ADC。
表1. 恒瑞医药ADC管线
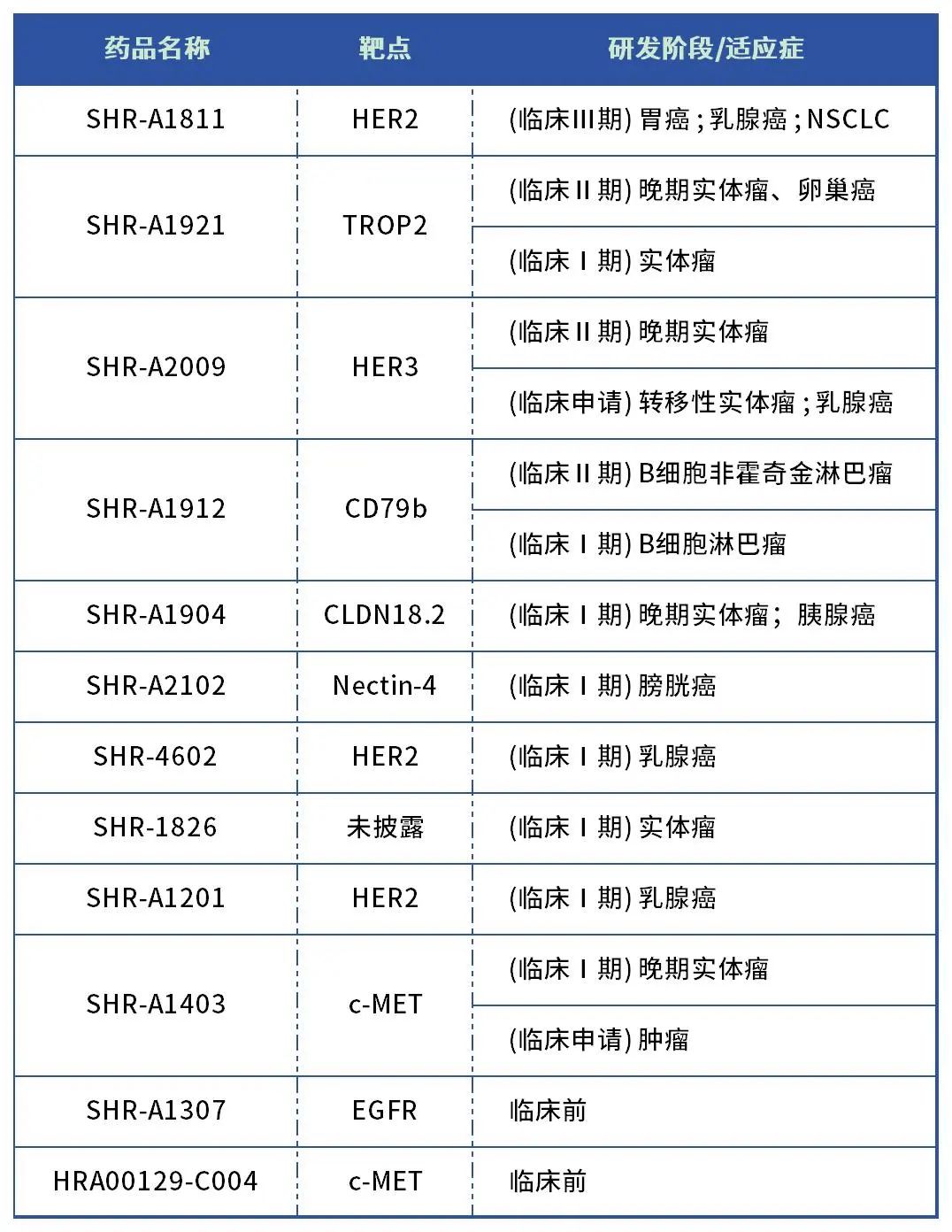
数据来源:恒瑞医药、药智头条整理
注:数据为作者手动整理,如有错漏欢迎指正。
从靶点来看,目前恒瑞医药在HER2、TROP2、CD79b、Claudin18.2、HER3、Nectin-4等多个靶点进行了全面布局。
基于该平台研发的首 款ADC产品SHR-A1811已经5次被纳入突破性治疗品种,这也是恒瑞进展最快的ADC。2024年开年,恒瑞的HER3 ADC产品SHR-A2009也获得了美国FDA快速通道资格认定。
SHR-A1811
SHR-A1811是一款对标第一三共T-DXd(DS-8201)的HER2 ADC新药,为恒瑞医药ADC管线的重点,也是进展最快的管线,目前已经推进到3期临床,已5次被CDE纳入突破性治疗品种,分别用于治疗:HER2阳性的复发或转移性乳腺癌、HER2低表达的复发或转移性乳腺癌、HER2突变的晚期非小细胞肺癌、HER2阳性结直肠癌、HER2阳性晚期胃癌或胃食管结合部腺癌。
SHR-A1811载荷为新型拓扑异构酶 I 抑制剂 SHR9265,具有更强的渗透性,进而提高ADC的旁观者杀伤效应;有效载荷与连接子临近处引入了一个手性环丙基,适当提高其稳定性,降低荷载药物的外周血释放;药物抗体比(DAR 值)为6,较T-DXd下调,获得更好的疗效和安全性参数。
在AACR 2023 大会上,恒瑞公布了 SHR-A1811 的1期临床试验数据。在HER2阳性乳腺癌患者中,经确认的客观缓解率(ORR)达76.9%,6个月的无进展生存(PFS)率为88.6%;在HER2低表达乳腺癌患者中,经确认的ORR为49.4%,6个月的PFS率为63.8%。其他HER2表达或突变实体瘤的经确认的ORR为53.6%,6个月的PFS率为73.4%。
在ESMO 2023大会上,恒瑞进一步公布了该研究中除乳腺癌之外其他晚期实体瘤使用SHR-A1811的结果。
有效性方面,85例可评估非乳腺晚期实体瘤患者中,ORR为45.9%(39/85;95%CI 35.0-57.0);疾病控制率(DCR)为88.2%(75/85;95%CI 79.4-94.2);中位至缓解时间(TTR)为1.4个月(范围0.7–5.8)。HER2 IHC3+患者ORR为54.1%(20/37),IHC2+患者为41.7%(10/24),IHC1+患者为50.0%(7/14)。
对于不同肿瘤类型,BTC患者的ORR为60.0%(9/15),UC患者为59.1%(13/22),GC/GEJA患者为50.0%(6/12),CRC患者为36.4%(4/11)(每种肿瘤类型的HER2状态数据如图4所示)。
安全性方面,共有50例(51.0%)患者发生≥3级治疗相关不良事件(TRAE);最常见(≥10%)不良事件是中性粒细胞计数下降和贫血。15例(15.3%)患者报告严重TRAE。值得注意的是,只有1例患者(1.0%)出现间质性肺病。
两次公布的结果提示,SHR-A1811在多癌种中取得了良好的ORR及安全性数据,具有BIC的潜力。
SHR-A1921
SHR-A1921是一款靶向 TROP2 的 ADC,与 SHR-A1811 采用同一载荷 SHR9265,通过可裂解连接子与 lgG1 mAb 连接,DAR 为 4。目前处于临床2期。
在AACR 2023 大会上,恒瑞公布了SHR-A1921用于晚期实体瘤的临床数据。有效性方面,10 例患者实现部分缓解(PR),包括5例NSCLC、2例三阴性乳腺癌、2例壶腹癌和1例卵巢癌。可评估患者的 ORR 为 33.3%(10/30;95% CI 17.3-52.8),DCR 为 80.0%(24/30;95% CI 61.4-92.3)。安全性方面,在所有剂量队列中,最常见的治疗相关不良事件 (TRAEs;≥30%) 是恶心 (71.1%)、口腔炎 (65.8%)、贫血 (42.1%)、呕吐、食欲下降、体重下降和皮疹 (各占 36.8%)。12 名患者 (31.6%) 发生了 ≥ 3 级 TRAE;其中,最常见的是口腔炎 (n=7, 18.4%)。没有患者因 TRAE 而停止研究治疗。
2024年1月,恒瑞医药在美国登记了SHR-A1921用于卵巢癌的II/III期研究(NCT06211023),探索相比研究者选择的含铂化疗,SHR-A1921联用或不联用卡铂用于复发性上皮性卵巢癌疗效和安全性,主要终点为研究者评估的ORR,次要终点包括DCR、DoR、mPFS、mOS和CA-125响应率。
同期,复旦大学登记了一项SHR-A1921联合贝伐珠单抗用于脑转移三阴性乳腺癌的II期研究(NCT06210438),主要终点为研究者评估的CNS CR或PR(RANO-BM标准),次要终点包括CNS CBR,mPFS,mOS,首次进展部位和安全性。
另外,针对 NSCLC 的注册3 期临床也已在筹划中。
SHR-A2009
SHR-A2009是一款HER3 ADC,目前处于2期临床。
2024年1月,恒瑞医药发布公告,SHR-A2009获得美国FDA授予快速通道资格(fast track designation, FTD),用于治疗经第三代EGFR酪氨酸激酶抑制剂和含铂化疗后疾病进展的EGFR突变的转移性非小细胞肺癌(NSCLC)。这是恒瑞历史上第一个获得美国FDA快速通道资格认定的创新药,意味着FDA对恒瑞ADC平台技术的认可。
HER3在实体瘤中广泛表达,与肿瘤生长扩散、耐药和不良预后相关,近年来HER3逐渐成为肺癌研究热门靶点。
2023年12月,百利天恒与BMS达成合作,共同开发和商业化 BL-B01D1,交易潜在总金额84亿美元。BL-B01D1是一款靶向HER3的双抗ADC。在2023ESMO大会上百利天恒公布了BL-B01D1治疗非小细胞肺癌患者的I期研究结果:在经过大量前线治疗的NSCLC,特别是EGFRmutNSCLC中表现出良好的疗效,观察到的毒性被认为是可接受的。
2023年10月,默沙东(MSD)和第一三共(Daiichi Sankyo)就第一三共的三个ADC候选药物达成了全球开发和商业化协议,合作总计数额可高达220亿美元。其中patritumab deruxtecan(U3-1402,HER3-DXd)是一款HER3 AD。在IASLC 2023世界肺癌大会上,第一三共公布了U3-1402的关键2期临床试验HERTHENA-Lung01数据。结果显示,在225例EGFR突变的NSCLC患者中,U3-1402组ORR为29.8%(95% CI:23.9~36.2)。其中1例完全缓解(CR),66例部分缓解(PR),99例疾病稳定。DOR为6.4个月(95% CI:4.9~7.8),DCR为73.8%(95% CI:67.5~79.4)。截止至2023年05月18日数据截止日期,PFS为5.5个月(95% CI:5.1~5.9个月),中位总生存期为11.9个月(95% CI:11.2~13.1个月)。2023年12月,美国FDA受理了HER3-DXd的BLA并授予其优先审评资格,用于治疗既往接受过两种或两种以上全身治疗的局部晚期或转移性EGFR突变非小细胞肺癌(NSCLC)成人患者。
可见各大药企对HER3 ADC的期待,恒瑞SHR-A2009进展不算最快,但也属于前列,未来商业化空间很大。
SHR-A1904
SHR-A1904是一款Claudin18.2 ADC,当前正在全球进行临床1期试验。
2023年10月,恒瑞医药与德国默克达成战略合作。根据协议,默克获得 PARP1 抑制剂 HRS-1167的全球(除中国)独家开发、生产和商业化许可,同时还获得恒瑞的 Claudin-18.2 ADC(SHR-A1904)的全球(除中国外)独家许可选择权。恒瑞获得1.6亿欧元的首付款、9000万欧元的技术转移费和行权费,以及研发里程碑付款、销售里程碑付款。以上潜在的付款总额可能高达14亿欧元。除此之外,默克还将向恒瑞支付高至两位数百分比的销售提成。
这是恒瑞医药首次与全球大型跨国企业达成战略合作,也是恒瑞医药首 个ADC授权交易。
除了上述几个ADC,恒瑞还有CD79b ADC药物SHR-A1912(临床Ⅱ期)、Nectin-4 ADC药物SHR-A2102(临床Ⅰ期) 、HER2 ADC药物SHR-4602(临床Ⅰ期) 、SHR-1826(临床Ⅰ期) ,此外恒瑞还曾披露过两个c-MET ADC药物:SHR-A1403和HRA00129-C004,以及EGFR药物SHR-A1307。
小 结
恒瑞布局创新药已有十数年历史,截至目前,恒瑞已有16款创新药上市,270多项临床试验正在国内外开展,每年产生10个FIC/BIC临床前候选化合物,产品管线非常丰富。
在肿瘤领域,恒瑞的小分子和单抗都取得了优秀成绩,如今开发的重点转移到了ADC。恒瑞医药自主研发了多个ADC技术平台:
基于替康类毒素ADC平台已经有多个分子进入临床前和临床开发。
开发具有自主知识产权的新一代定点偶联技术,以提高ADC的均一性。
开发具有不同作用机制的新型细胞毒载荷(Payloads)及新linker,拓展新的治疗领域和适应症,实现更多样的ADC产品布局。
开展新型双抗体ADC项目。
新偶联技术运用于抗体-光敏剂偶联物(APC)和抗体-放射 性核素偶联物(ARC)领域。
从目前公布的数据来看,恒瑞的ADC不仅多,而且数据都还不错,多个产品具有BIC潜质,期待更多数据的公布。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57