2月18日,国家药监局药审中心公开征求ICH《Q2(R2)/Q14:分析方法验证和分析方法开发》实施建议和中文版意见,并附《Q2(R2)/Q14指导原则实施建议》等5个附件。

图片来源:CDE官网
其中,《Q2(R2):分析方法验证》实施建议如下:
一、申请人需在现行药学研究技术要求基础上,按照Q2(R2)指导原则的要求开展研究;本公告发布之日起6个月后开始的相关研究(以试验记录时间点为准),均适用Q2(R2)指导原则。
二、相关技术指导原则可在国家药品监督管理局药品审评中心网站查询。国家药品监督管理局药品审评中心负责做好本公告实施过程中的相关技术指导工作。
《Q14:分析方法开发》实施建议如下:
一、Q14指导原则提供了两种开发方式,申请人可以自行选择基础(即传统)方式或者增强方式,也可以选择部分采用增强方式。
二、申请人需在现行药学研究技术要求基础上,按照Q14指导原则的要求开展研究;本公告发布之日起6个月后开始的相关研究(以试验记录时间点为准),均适用Q14指导原则。
三、Q14指导原则涉及分析方法全生命周期与变更管理,可能有同时涉及到《Q12:药品生命周期管理的技术与法规考虑》(以下简称Q12)指导原则的相关内容,如既定条件(EC)。申请人如提交同时涉及到Q12指导原则相关内容的注册申请,请同时执行Q12指导原则实施建议要求。
四、相关技术指导原则可在国家药品监督管理局药品审评中心网站查询。国家药品监督管理局药品审评中心负责做好本公告实施过程中的相关技术指导工作。
以下为《Q2(R2):分析方法验证》中文版目录


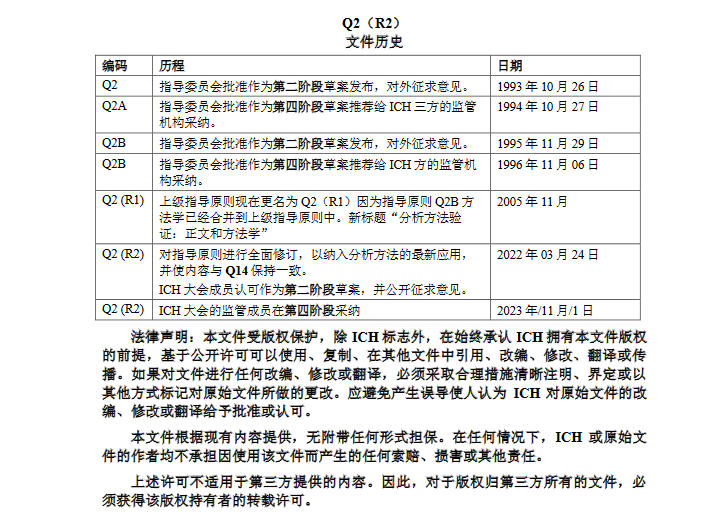




图片来源:CDE官网
以下为《Q14:分析方法开发》中文版目录

图片来源:CDE官网



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57