2023年,FDA共批准了15款肿瘤创新药,包括4款双抗新药、5款单抗及多肽类药物、6款小分子药物。多个全新靶点及全新机制药物获批上市,如首 个AKT抑制剂、首 个口服SERD抑制剂及首 个可逆BTK抑制剂等。
其中,多款国产肿瘤创新药成功登陆美国市场,如和黄医药的呋喹替尼、君实生物的特瑞普利单抗、亿帆医药的艾贝格司亭α注射液,标志着国产创新药出海实力的稳步提升。
表:2023年FDA批准上市的抗肿瘤创新药
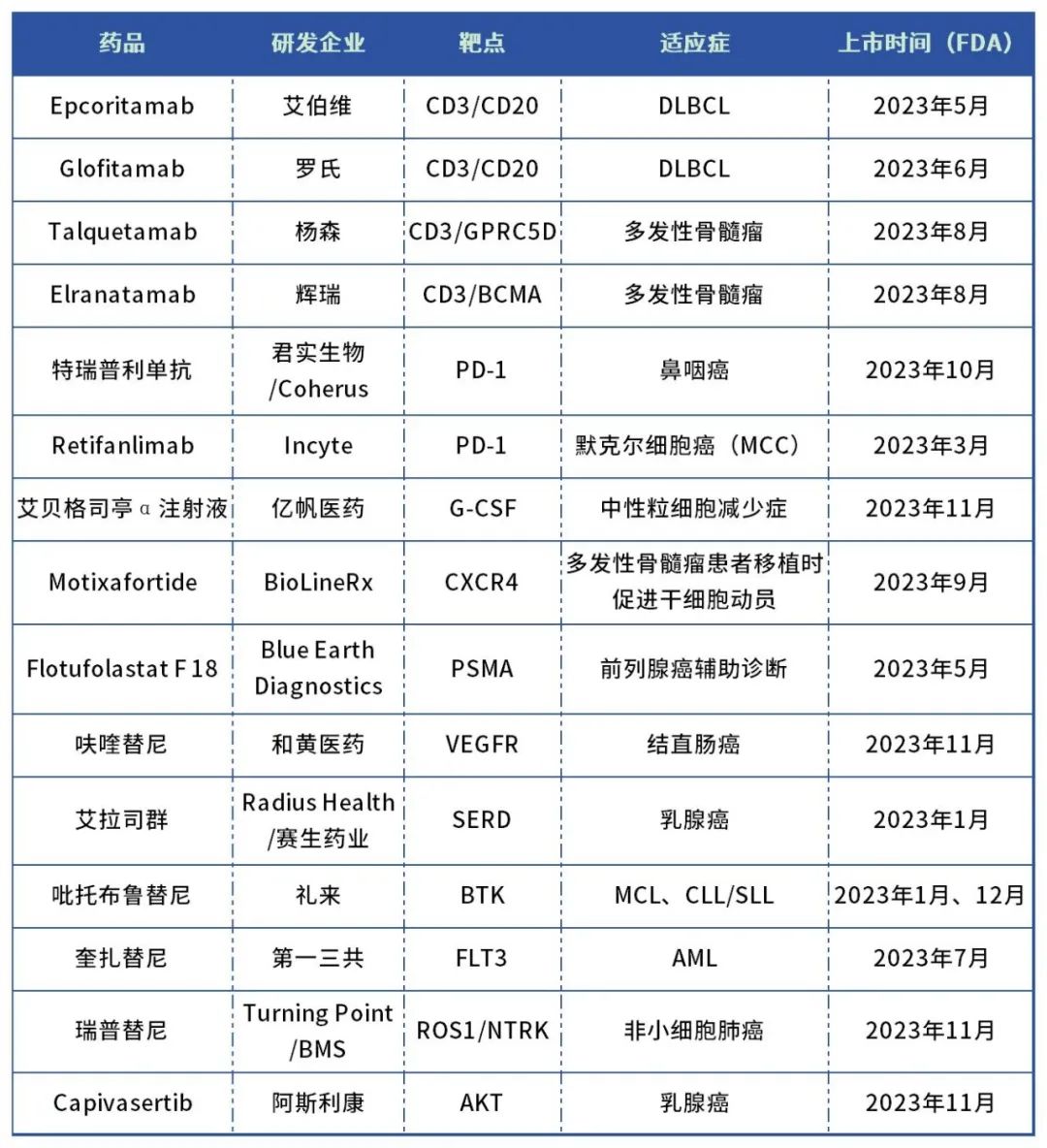
数据来源:药智数据、公开资料整理
双抗药物
2023年,可谓是双抗的大年,FDA共批准4款双抗药物上市,包括CD3/CD20双抗Epcoritamab及Glofitamab,CD3/GPRC5D双抗Talquetamab及CD3/BCMA双抗Elranatamab。
(1)Epcoritamab(Epkinly)是艾伯维旗下一款CD3/CD20双抗,于2023年5月获FDA批准上市,用于经过两线或多线系统性治疗后复发或难治性(R/R)弥漫性大B细胞淋巴瘤(DLBCL)。Epcoritamab-bysp可同时结合T细胞上的CD3和B细胞上的CD20,并诱导T细胞介导的CD20+细胞杀伤。
Epcoritamab的上市基于I/II期EPCORE NHL-1试验的研究结果。试验结果显示,在所有接受Epcoritamab治疗的DLBCL患者中,客观缓解率(ORR)为61%,完全缓解率(CR)为38%,部分缓解率(PR)为23%。中位缓解持续时间(DOR)为15.6个月,9个月的DOR率为63%。
(2)Glofitamab是罗氏旗下一种新型lgG1样人源化的CD20xCD3双特异性抗体,于2023年6月15日获FDA批准上市,用于治疗接受过2线及以上系统性治疗的复发/难治性(R/R)非特指型弥漫性大B细胞淋巴瘤(DLBCL,NOS)或滤泡性淋巴瘤引起的大B细胞淋巴瘤(LBCL)成年患者。
Glofitamab获得美国FDA的批准是基于I/II期NP30179研究中的积极结果。研究结果显示,接受格罗菲妥单抗治疗的DLBCL患者获得了持久缓解,总体缓解率(ORR)56%(74/132),完全缓解率(CR)43%。此外,在对治疗有应答的人中,超过2/3的人表现出至少持续9个月的缓解。中位缓解持续时间(mDOR)为18.4个月。
(3)Talquetamab是杨森公司旗下一款CD3/GPRC5D双抗,于2023年8月获FDA批准上市,适应症为至少接受过四种先前治疗的成年复发或难治性多发性骨髓瘤患者。
Talquetamab的上市基于II期MonumenTAL-1研究结果。该试验纳入了187例既往接受过至少4线治疗且既往未接受过T细胞重定向治疗的患者。当给药频率为每两周皮下注射0.8 mg/kg时,73.6%的患者达到ORR,58%达到非常好的部分缓解(VGPR)或以上疗效,其中约30%获得完全缓解(CR)或更好。
(4)Elranatamab是辉瑞旗下一款CD3/BCMA双抗,于2023年8月获FDA批准用于治疗既往接受过至少四线治疗(包括蛋白酶体抑制剂、免疫调节剂和抗CD38单克隆抗体)的复发或难治性多发性骨髓瘤(R/R MM)成人患者。
Elranatamab是获批是基于一项名为MagnetisMM-3的2期试验数据。这项研究共纳入了187名对至少1种PI、1种IMiD和1种抗CD38单克隆抗体耐药的多发性骨髓瘤患者。其中关键队列A共有123名未接受过BCMA定向治疗的患者,总体缓解率(ORR)高达57.7%,完全缓解率为25.8%;队列B由64名之前接受过BCMA靶向抗体药物偶联物或CAR-T细胞疗法的患者组成,总体缓解率(ORR)为33.3%,9个月DOR率为84.3%。
单抗及多肽药物
2023年,FDA共批准五款单抗及多肽药物上市,其中两款为国产药物,包括君实生物的特瑞普利单抗、亿帆医药的艾贝格司亭α注射液,国产创新药出海正不断提速。
(1)特瑞普利单抗是君实生物旗下一款PD-1单抗,于2023年10月29日获FDA批准用于治疗一线鼻咽癌及既往含铂治疗过程中或治疗后疾病进展的复发性、不可切除或转移性鼻咽癌。
2021年2月2日,君实生物与Coherus公司签署了许可与商业化协议。根据协议条款,君实生物将授予Coherus特瑞普利单抗和两个可选项目的许可,并获得总额最高达11.1亿美元的首付款、可选项目执行费和里程碑付款。其中首付款1.5亿美元,在达到相应的里程碑事件后,君实生物将收到累计不超过3.8亿美元的里程碑款,外加许可区域内特瑞普利单抗年销售净额20%的销售分成。
(2)Retifanlimab是Incyte公司旗下一款PD-1单抗,于2023年3月获FDA批准上市,用于治疗转移性或复发性局部晚期默克尔细胞癌(MCC)成人患者。
Retifanlimab此次的获批基于一项开放标签、单臂的II期临床研究(POD1UM-201)数据。
结果显示,在此前未接受过化疗的患者(n=65)中,Retifanlimab单药治疗的客观缓解率(ORR)为52%。其中12名患者(18%)获得完全缓解,22名患者(34%)获得部分缓解。在获得缓解的患者中,缓解持续时间(DOR)为1.1-24.9个月。76%(26/34)患者DOR超过6个月,62%(21/34)患者DOR超过12个月。
(3)艾贝格司亭α注射液(F-627)是亿帆医药控股子公司亿一生物旗下的第三代长效升白药物,也是全球首 个双分子G-CSF-Fc融合蛋白,具有高稳定性、低免疫原性的显著优势。2023年11月,艾贝格司亭α注射液获FDA批准上市,用于成年非髓性恶性肿瘤患者在接受容易引起发热性 中性粒细胞减少症的骨髓抑制性抗癌药物治疗时,降低以发热性 中性粒细胞减少症为表现的感染发生率。
(4)Motixafortide是BioLineRx旗下的一种合成环肽,靶向CXCR4,于2023年9月获FDA批准上市,适应症为联合filgrastim(粒细胞集落刺激因子G-CSF)动员造血干细胞至外周血,以作为多发性骨髓瘤患者在移植时促进患者自体移植的干细胞动员(SCM)。APHEXDA通过皮下注射给药,是十年来首 个在多发性骨髓瘤干细胞动员方面获得FDA批准的创新药物。
Motixafortide的上市基于两部分的GENESIS临床Ⅲ期试验的结果,该试验是一项随机双盲、安慰剂对照的研究,评估了Motixafortide加G-CSF,相比安慰剂加G-CSF动员造血干细胞用于多发性骨髓瘤患者自体移植的安全性和有效性。根据中央实验室的测量结果,Motixafortide加G-CSF联合方案使得67.5%的患者在两次单采治疗中达到干细胞实现采集每公斤≥600万个CD34阳性细胞的目标,而此数值在安慰剂加G-CSF方案组当中仅为9.5%。
(5)Flotufolastat F18是一种优化的PSMA靶向分子,与表达PSMA的细胞结合并被其内化,包括通常过度表达PSMA前列腺癌细胞。它被标记为放射 性同位素氟-18(18F),以便对前列腺和前列腺癌可能扩散的身体其他区域进行PET成像。Flotufolastat F 18于2023年5月获FDA批准上市,是第一个也是唯一一个获得美国食品药品监督管理局批准的PSMA靶向成像剂。
小分子药物
2023年,FDA共批准6款小分子药物上市,包括首 款口服SERD抑制剂艾拉司群、首 个非共价可逆BTK抑制剂吡托布鲁替尼、首 个AKT抑制剂Capivasertib。和黄医药的呋喹替尼于11月获FDA批准上市,是国产小分子药物出海的里程碑事件。
(1)呋喹替尼是和黄医药旗下一种高选择性、强效的血管内皮 生长因子受体(VEGFR)-1、-2及-3抑制剂,于2023年11月获FDA批准上市,适应症为既往曾接受过氟尿嘧啶类、奥沙利铂和伊立替康为基础的化疗、抗血管内皮 生长因子("VEGF")治疗,以及抗表皮生长因子受体(EGFR)治疗的成人转移性结直肠癌患者。
2023年1月,和黄医药与武田达成合作,武田通过向和黄医药支付4亿美元首付款和高达7.3亿美元的潜在里程碑费用获得呋喹替尼的海外权益,成为国产创新药向海外大药企授权交易中首付款金额最高的合作项目之一。呋喹替尼在FDA的获批触发3500万美元的里程碑付款。
(2)艾拉司群(elacestrant)是全球首 款获批上市的口服SERD抑制剂,于2023年1月获FDA批准上市,适应症为用于既往接受过至少一线内分泌治疗后疾病进展的ER+、HER2-、ESR1突变的绝经后女性或成年男性晚期或转移性乳腺癌患者。
与氟维司群相比,艾拉司群在ESR1突变的HR+、HER2-乳腺癌患者优势明显,在一项名为EMERALD的III期临床试验,研究纳入478例ER+、HER2-晚期或转移性绝经后女性和男性患者,其中228例患者有ESR1突变。elacestrant组和氟维司群或芳香化酶抑制剂组的中位PFS分别为3.8个月和1.9个月(HR=0.55 ,p值=0.0005)。艾拉司群头对头战胜氟维司群。
艾拉司群的获批将填补目前ER+/HER2-、ESR1突变晚期乳腺癌后线治疗的空缺,同时也为CDK4/6抑制剂耐药患者提供了一种安全有效的治疗方式,进一步丰富了内分泌耐药乳腺癌患者的诊疗格局。
2023年11月7日,赛生药业与美纳里尼集团就艾拉司群达成独家许可及合作协议,获得在中国境内开发和商业化艾拉司群的权益。
(3)吡托布鲁替尼(Pirtobrutinib,LOXO-305)是礼来旗下新一代BTK抑制剂,是FDA批准的首 个且唯一一款非共价可逆BTK抑制剂,可以解决一代不可逆BTK抑制剂的耐药问题。吡托布鲁替尼于2023年获批两项适应症,先于2023年1月27日获批既往接受过至少二线系统治疗(包括BTK抑制剂)的复发或难治性MCL成人患者。后于2023年12月1日获批用于既往接受过至少两线治疗(包括BTK抑制剂和BCL-2抑制剂)的慢性淋巴细胞白血病或小淋巴细胞淋巴瘤(CLL/SLL)成人患者。
吡托布鲁替尼的上市基于一项名为BRUIN的Ⅰ/Ⅱ期试验,100名先前接受过BTK和Bcl-2的CLL/SLL患者总缓解率达79%,中位无进展生存期为16.8个月,对于BTK和Bcl-2抑制剂耐药的CLL/SLL患者有良好疗效。
(4)奎扎替尼(quizartinib)是一种每日1次口服的强效、选择性第二代2型FLT3抑制剂,于2023年7月20日获FDA批准用于一线治疗和辅助诊断罕见的FLT3-ITD阳性的急性髓性白血病(AML),FLT3突变是AML患者最常见的基因突变之一,与AML复发风险高和预后不良有关,大约30%的初治AML患者发生FLT3突变。
奎扎替尼的上市基于一项名为QuANTUM-First的三期研究,539名新诊断的FLT3-ITD阳性AML患者随机(1:1)接受quizartinib(n=268)或安慰剂(n=271)联合标准诱导和巩固治疗,然后继续接受单药维持治疗。研究结果显示,与安慰剂组相比,接受quizartinib联合标准诱导和巩固化疗治疗,然后继续接受quizartinib单药治疗的患者,总生存期(OS)有统计学意义的改善,mOS分别为31.9m和15.1m(HR为0.78)。但quizartinib有尖端扭转性室性心动过速和心脏骤停的黑框警告。
(5)瑞普替尼(Repotrectinib)是BMS和再鼎医药联合开发的一款靶向ROS1和NTRK致癌因子的新一代激酶抑制剂,于2023年11月获FDA批准上市,用于治疗ROS1阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
瑞普替尼的上市基于I/II期TRIDENT-1试验的研究结果,瑞普替尼在ROS1-TKI初治患者(n=71)中,客观缓解率(ORR)为79%,其中完全缓解率(CR)为6%,部分缓解率(PR)为73%。在既往接受过一种ROS1-TKI且未接受过化疗的患者(n=56)中,ORR为38%,CR为5%,PR为32%。
2020年的7月,再鼎医药与Turning Point公司达成合作,获得了在大中华地区(包括中国大陆,香港,澳门和台湾地区)对瑞普替尼的独家开发和商业化权益。2023年6月28日,再鼎医药宣布,国家药品监督管理局(NMPA)已受理瑞普替尼(Repotrectinib)的新药上市申请,用于治疗ROS1阳性的局部晚期或转移性非小细胞肺癌(NSCLC)的成人患者。
(6)Capivasertib是阿斯利康旗下的一款AKT抑制剂,于2023年11月获FDA批准上市,适应症为与Fulvestrant(氟维司群)联合使用,治疗激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的晚期或转移性乳腺癌成年患者。Capivasertib是全球首 款上市的AKT抑制剂。
Capivasertib的上市基于一项名为CAPItello-291的三期研究,708 名局部晚期或转移性 HR 阳性、HER2 阴性乳腺癌患者随机 (1:1) 接受 capivasertib 400 mg 或安慰剂口服给药,研究组和对照组患者均在第 1 个周期的第 1 天和第 15 天肌肉注射氟维司群 500 mg,此后每 28 天注射一次。结果显示,Capivasertib-氟维司群组的中位 PFS为7.3个月,安慰剂-氟维司群组为3.1个月(HR=0.50,p值< 0.0001)。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57