2月16日,FDA批准了Iovance Biotherapeutics的lifileucel(商品名:AmtagviTM)上市,用于治疗PD-1抗体治疗后病情进展的晚期黑色素瘤成年患者,定价51.5万美金。这是全球首 个获FDA批准的肿瘤浸润淋巴细胞疗法(TIL)。目前Amtagvi仅允许用于自体使用,并带有治疗相关死亡、长期严重细胞减少症、严重感染以及心肺和肾脏损害的黑框警告。
Iovance于2023年3月完成了向FDA提交的滚动BLA,临床数据显示,lifileucel的客观缓解率为31%,随访18.6个月时未达到中位缓解持续时间,42%的缓解持续时间为两年或更长。
FDA生物制品评估和研究中心主任Peter Marks在一份声明中说:“Amtagvi的批准是科学和临床研究共同努力而达到的高峰,这将为治疗选择极其有限的患者带来一种新的T细胞免疫疗法。”
据了解,美国每年约有8000人死于黑色素瘤。黑色素瘤基金会AIM主席Samantha R. Guild在一份新闻稿中说:“对于那些经过标准治疗后病情依旧进展的晚期黑色素瘤患者来说,Amtagvi的批准带来了生存的希望,因为目前的标准治疗方案对许多患者无效。”
TIL(tumor infiltrating lymphocyte)技术的发展可以追溯到40年前。1982年,美国国家癌症研究所Steven Rosenberg 及其同事利用小鼠细胞开发了TIL技术,1988年他们又将该方法应用于治疗黑色素瘤患者,动物研究以及临床试验结果都显示TIL技术可以有效地治疗晚期黑色素瘤。
TIL疗法,又称细胞免疫治疗,是肿瘤的免疫治疗方法之一。免疫细胞(淋巴细胞)在肿瘤微环境中往往被抑制。TIL疗法就是从患者肿瘤组织中分离出肿瘤浸润的淋巴细胞,经体外扩增或改良后再回输到体内的疗法。TIL通过独特的肿瘤细胞表面的肿瘤标记物来识别癌症。实体肿瘤免疫靶点有很大的个体化差异,在不同患者中可共享的不到1%。TIL疗法被认为是当前实体瘤免疫治疗领域最 具竞争力和产业化潜力的技术方向之一。
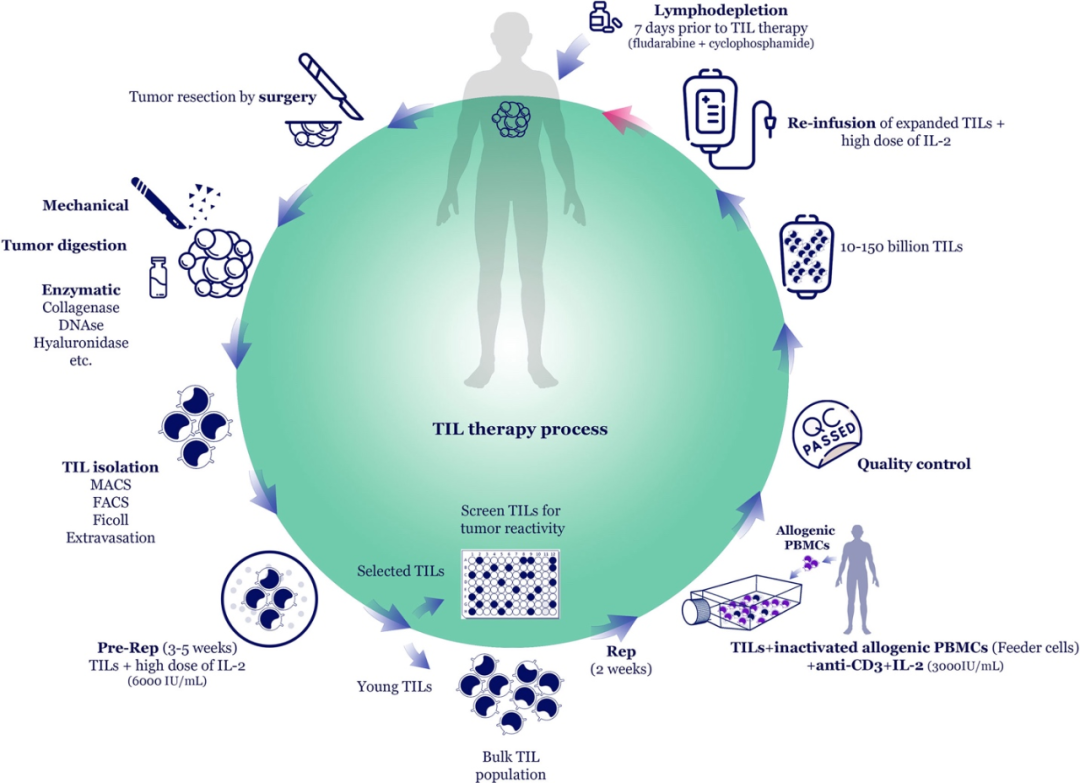
TIL Process
图片来源:doi.org/10.3389/fimmu.2022.1018962
尽管CAR-T疗法已经成功地改变了血液肿瘤的治疗方式,但大量事实证明CAR-T对于占肿瘤病例90%的实体肿瘤治疗效果并不理想。与CAR-T疗法相比,TIL疗法的吸引力之一在于能够同时识别来自细胞内或细胞外的多种抗原,这是CAR-T无法做到的,传统的CAR-T只能识别肿瘤细胞表面的少量蛋白质。
虽然此次Amtagvi获批是TIL领域的一大胜利,但在扩大生产规模、缩短这一复杂疗法的生产周期、如何降低生产成本,以及如何支付等方面还有诸多挑战。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57