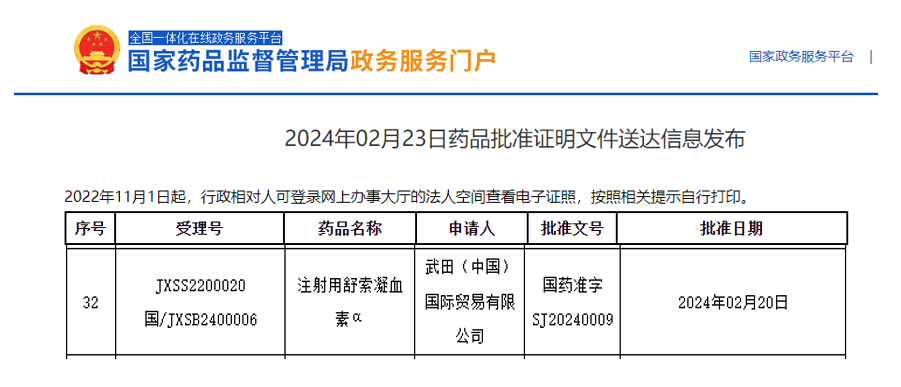
2024年2月23日,从NMPA官网公示可知,武田中国旗下创新药注射用舒索凝血素α(Susoctocog alfa)在国内获批上市。获批适应症:获得性血友病A成人患者按需治疗和出血事件的控制。
舒索凝血素α原研公司为Baxalta,该公司是百特国际(Baxter International)于2015年拆分并上市的生物制药公司,2016年Shire出资320亿美元,收购了Baxalta,此后武田620亿美元大手笔收购Shire,该产品最终也归于武田。
获得性血友病A是一种获得性出血性疾病,患者由于循环血中出现抗凝血因子VIII自身抗体导致FVIII活性降低,年发病率约为1.5/100万,老年人(中位年龄64-78岁)最常见,亦有儿童和产后病例的报道。患者常表现为严重的自发性或创伤后出血,但少数为无症状。中国获得性血友病登记(CARE)研究中死亡率为6.7%,获得性血友病A患者首次就诊时严重出血约占60.9%
从武田官网了解到,Obizur(Susoctocog alfa)是首 个获得FDA以及EMA批准用于获得性血友病A的重组猪FVIII(rpFVIII)药物。Susoctocog alfa与人序列凝血因子VIII(FVIII)结构相似、序列同源,且不易受到抗人FVIII自身抗体的灭活,可以替代人FVIII发挥明显的止血作用。在一项前瞻性、2/3期多中心、开放标签临床试验中,共入组28位获得性血友病A患者,100%的患者在给药后24小时出现疗效可评估的反应(出血停止或减少)。其中 94%(16/17)的患者接受了rpFVIII作为一线治疗。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57