2月26日,百济神州发布2023年第四季度和全年财务业绩以及业务亮点,业务持续快速增长,营收再创新高,2023年第四季度总收入达6.34亿美元,同比增长67%;全年总收入达25亿美元,同比增长74%
百悦泽®(泽布替尼)在血液学领域进一步巩固领导地位,2023年第四季度全球销售额达4.13亿美元,同比增长135%;全年全球销售额达13亿美元,同比增长129%
全力推进血液学创新研发管线,sonrotoclax启动四项注册性试验,包括用于治疗初治慢性淋巴细胞白血病(CLL)的全球3期试验;BTK CDAC启动两项用于治疗复发或难治性(R/R)CLL、R/R套细胞淋巴瘤(MCL)的全球扩展队列研究
凭借多样化的产品和地区收入组合、不断改善的经营杠杆效益,实现持续增长
关键业务进展和管线亮点
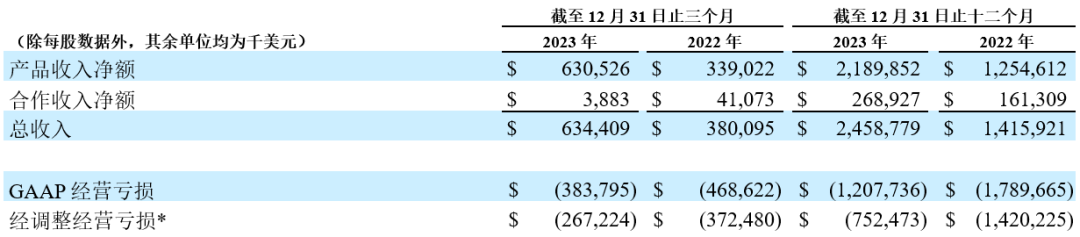
2023年第四季度,公司产品收入达6.305亿美元,同比增长86%;全年产品收入达22亿美元,同比增长75%。
得益于对经营费用的严格管理,按美国公认会计原则(GAAP)计算,2023年第四季度和全年,经营亏损分别减少了18%和33%;经调整经营亏损分别减少了28%和47%。
美国食品药品监督管理局(FDA)批准百悦泽®的说明书更新,纳入3期ALPINE试验中,对比亿珂®(伊布替尼)治疗既往经治复发或难治性(R/R)慢性淋巴细胞白血病(CLL)患者取得的无进展生存期(PFS)优效性结果(中位随访时间29.6个月),进一步巩固百悦泽®作为首选BTK抑制剂的地位。
扩大百悦泽®全球适应症范围,包括获得欧盟委员会批准,用于治疗既往接受过至少两线系统性治疗的R/R滤泡性淋巴瘤(FL)成人患者,成为迄今为止首 个在该项适应症获批、以及同类产品中获批适应症最广泛的BTK抑制剂。
在2023年12月举行的美国血液学会(ASH)年会上,公布25项摘要,突出公司在血液学领域的领导地位和实力,包括:
更新ALPINE试验数据,在中位随访39个月时,百悦泽®对比亿珂®在治疗R/R CLL成人患者中持续展示出更优的PFS结果。
公布sonrotoclax 1/2期试验数据,与百悦泽®联合用于治疗初治CLL时展示出良好的安全性和耐受性,且具有深度和持久的疗效;sonrotoclax用于治疗R/R边缘区淋巴瘤患者具有良好的单药活性;以及sonrotoclax与地塞米松联合用于治疗携带t(11,14)的多发性骨髓瘤(MM),具备令人鼓舞的疗效和安全性。
公布正在进行的BTK CDAC(BGB-16673)首 个人体临床试验数据:在治疗既往接受过多线治疗的B细胞恶性肿瘤患者中(包括BTK抑制剂耐药患者),BTK CDAC展现出显著的临床缓解和可耐受的安全性特征。
扩大抗PD-1抗体百泽安®(替雷利珠单抗)在全球的影响力,获得欧洲药品管理局(EMA)人用药品委员会(CHMP)的积极意见,推荐其用于治疗非小细胞肺癌(NSCLC)的三项适应症;用于一线治疗食管鳞状细胞癌(ESCC)成人患者的上市申请已获EMA受理;并正在接受美国和欧洲等10个国家和地区监管机构的审评;
持续推动创新研发战略,在2023年内共推动5个新分子实体(NMEs)进入临床,包括潜在“同类最 佳”CDK4抑制剂BGB-43395。
2023年第四季度和全年财务亮点
总收入:2023年第四季度总收入为6.344亿美元,全年总收入为25亿美元,上一年同期分别为3.801亿美元和14亿美元。本季度总收入较上年同期增长主要得益于公司核心市场产品销售额的增长。2023年第四季度和全年,美国是公司收入最高的市场,该市场的总收入分别为3.132亿美元和11亿美元,而上年同期分别为1.554亿美元和5.026亿美元。随着百悦泽®在美国的销售额持续增长,公司预计将在2024年继续保持这一趋势。
*关于公司使用非GAAP财务指标的说明,请参阅本新闻稿“非美国公认会计原则(GAAP)财务指标的使用”部分;关于每项非GAAP财务指标与最可比GAAP指标的调节,请参阅本新闻稿末尾的表格。
图片来源:百济神州企业官微
产品收入:2023年第四季度,产品收入为6.305亿美元,全年产品收入为22亿美元,上一年同期分别为3.390亿美元和13亿美元。产品收入具体包括:
百悦泽®2023年第四季度全球销售额为4.130亿美元,全年全球销售额为13亿美元,上一年同期分别为1.761亿美元和5.647亿美元;
百泽安®2023年第四季度的销售额为1.280亿美元,全年销售额为5.366亿美元,上一年同期分别为1.022亿美元和4.229亿美元;
安进公司授权产品2023年第四季度的销售额为5,110万美元,全年销售额为1.883亿美元,上一年同期分别为2,770万美元和1.146亿美元。
毛利率:2023年第四季度和全年,毛利占全球产品收入分别为83.2%和82.7%,上年同期为78.3%和77.2%。季度及全年的毛利率同比均取得增长,主要是由于与我们的其他产品组合以及毛利率较低的授权许可产品相比,百悦泽®全球产品销售额占比较高,且百悦泽®和百泽安®的单位成本较低。
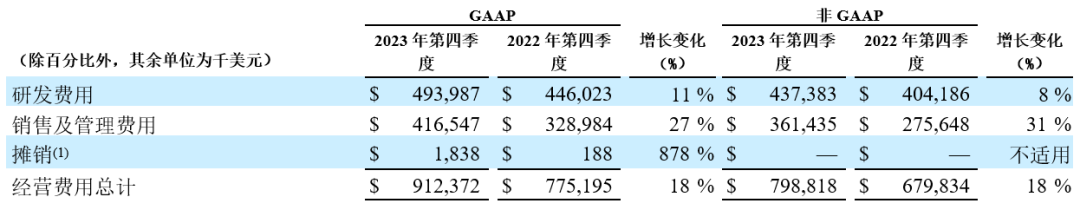
经营费用:2023年第四季度和2022年第四季度的经营费用分别汇总如下:
图片来源:百济神州企业官微
2023年和2022年全年的经营费用分别汇总如下:
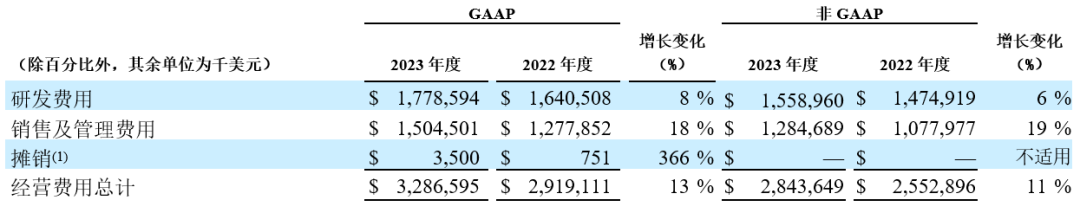
(1) 与百时美施贵宝产品分销权相关的无形资产已于2023年12月31日摊销完毕,届时分销权将根据和解协议条款归还至百时美施贵宝。
图片来源:百济神州企业官微
研发费用:2023年第四季度和全年,GAAP和经调整研发费用均同比增长,主要是由于对新技术平台和药物模式的投入,从而将临床前项目推进临床、早期临床项目推进后期发展阶段。2023年第四季度和全年,正在进行中的授权引入候选药物研发相关的预付款分别为3,180万美元和4,680万美元,上年同期分别为4,870万美元和6,870万美元。
销售及管理(SG&A)费用:2023年第四季度和全年,GAAP和经调整SG&A费用均有所增加,主要是由于百悦泽®在全球实现商业化上市的持续投入,尤其是在美国和欧洲。
净亏损:2023年第四季度和全年,按GAAP计算,净亏损较去年同期有所改善,主要由于经营亏损减少,并因BMS仲裁和解获得3.629亿美元的非经营收入。
2023年第四季度,每股净亏损为0.27美元,每股美国存托股份(ADS)净亏损为3.53美元;上一年同期每股净亏损为0.33美元,每股ADS净亏损为4.29美元。2023年全年,每股净亏损为0.65美元,每股ADS净亏损8.45美元;上一年同期每股净亏损1.49美元,每股ADS净亏损19.43美元。
现金、现金等价物、受限资金:

图片来源:百济神州企业官微
经营活动所用现金:2023年第四季度和全年,GAAP和经调整SG&A费用均2023年第四季度和全年分别为2.216亿美元和12亿美元,上一年同期为3.182亿美元和15亿美元,这一费用的减少主要是由于经营杠杆效益的改善。
关于公司2023年度财务报表的更多详细信息,请参阅百济神州向美国证券交易委员会提交的2023年年度报告10-K表格。
药政进展和研发项目
近期里程碑
核心亮点:
百悦泽®在美国获批更新说明书,纳入无进展生存期(PFS)优效性结果,同时在欧盟和加拿大获批R/R滤泡性淋巴瘤(FL)适应症,进一步巩固其作为首选BTK抑制剂的地位。
扩大百泽安®的全球足迹,目前已在美国和欧洲等10个市场递交注册申请。
Sonrotoclax用于一线治疗CLL的全球Ⅲ期试验,以及针对BTK CDAC的潜在注册可用的扩展队列研究均已入组首例患者。
注册批准
百悦泽®(泽布替尼)
获得美国FDA对更新说明书的批准,纳入在3期ALPINE试验中治疗R/R CLL/SLL成人患者取得的PFS优效性结果
获得欧盟委员会和加拿大卫生部批准,联合奥妥珠单抗用于治疗既往接受过至少两线系统性治疗的R/R FL成人患者
新增4个市场,获得治疗R/R和初治(TN)CLL适应症注册批准
百泽安®(替雷利珠单抗)
获得中国国家药品监督管理局(NMPA)批准,用于一线治疗不可切除肝细胞癌患者
获得英国药品与健康产品管理局(MHRA)批准,用于二线治疗晚期ESCC患者
注册申报
替雷利珠单抗
获得EMA CHMP的积极意见,推荐批准替雷利珠单抗用于治疗NSCLC的三项适应症
一项联合化疗用于既往未经治疗的广泛期小细胞肺癌(ES-SCLC)患者的新适应症上市申请(sBLA)获NMPA受理
一项联合含铂化疗作为新辅助治疗、后续进行替雷利珠单抗辅助治疗用于可切除的II期或IIIA期非小细胞肺癌(NSCLC)成人患者新适应症的上市申请获NMPA受理
用于一线治疗ESCC成人患者的新适应症上市申请获EMA受理
临床进展
百悦泽®
在ASH年会上,公布3期ALPINE试验的积极随访数据,百悦泽®对比亿珂®在治疗R/R CLL/SLL中展现出持续的PFS获益,且心血管事件发生率持续较低
替雷利珠单抗
在一项皮下注射用于一线治疗晚期或转移性NSCLC的1期试验中,入组首例患者
Sonrotoclax(BGB-11417)
获得美国FDA“孤儿药”资格认定,用于治疗多发性骨髓瘤(MM)、华氏巨球蛋白血症(WM)、急性髓系白血病(AML)和套细胞淋巴瘤(MCL)
在与百悦泽®联合用于一线治疗CLL患者的全球关键性试验中,入组首例患者
在ASH年会上,公布sonrotoclax多项数据:
◆ 与百悦泽®联用,展示出良好的安全性和耐受性,且对治疗TN CLL有深度和持久的疗效
◆ 展示出令人鼓舞的数据,有望成为首 款在携带t(11,14)的MM适应症中获批的BCL-2抑制剂
◆ 在治疗R/R MZL中,展示出良好的单药活性
BTK CDAC(BGB-16673)
在ASH年会上,公布正在进行的首次人体临床试验数据:在治疗既往接受过多线治疗的B细胞恶性肿瘤患者时(包括BTK抑制剂耐药患者),BTK CDAC展现出显著的临床缓解和可耐受的安全性特征
在一项用于治疗R/R MCL的潜在注册可用的扩展队列研究中,入组首例患者
获得美国FDA授予的快速通道资格、“孤儿药”资格认定,用于治疗R/R MCL
LBL-007(抗LAG3抗体)1
与维立志博合作,在一项与替雷利珠单抗和化疗联合用于一线治疗不可手术、局部晚期或转移性ESCC患者的2期试验中,入组首例受试者
早期研发
新分子实体(NME)BGB-43395(CDK4抑制剂)的1期临床试验,前两组患者已全部入组
预计里程碑事件
核心亮点:
百悦泽®预计将获得美国FDA批准,联合奥妥珠单抗用于治疗R/R FL,成为同类产品中获批适应症最广泛的BTK抑制剂。
替雷利珠单抗预计将获得美国FDA批准,用于一线和二线治疗ESCC,进一步深化公司在实体瘤领域创新产品组合的全球布局。
预计注册批准
百悦泽®
预计将于2024年3月和6月分别获得美国FDA和NMPA批准,联合奥妥珠单抗用于治疗既往接受过至少两线系统性治疗的R/R FL成人患者
替雷利珠单抗
预计将于2024年上半年获得美国FDA批准,用于治疗二线ESCC
获得美国FDA批准,用于一线治疗不可切除、复发性、局部晚期或转移性ESCC患者,《处方药使用者付费法案》(PDUFA)目标审评日期为2024年7月
预计将于2024年上半年获得EMA批准,联合化疗用于一线和单药用于二线治疗转移性NSCLC
预计将于2024年第三季度获得NMPA批准,联合化疗用于治疗既往未经治疗ES-SCLC
预计将于2024年第二季度获得NMPA批准,用于一线治疗不可手术、局部晚期或转移性胃或胃食管结合部(G/GEJ)腺癌
预计注册申报
百悦泽®
预计将于2024年上半年,向EMA和加拿大卫生部递交一项片剂新剂型上市申请;于2024年下半年向美国FDA递交该项新剂型上市申请
替雷利珠单抗
预计将于2024年上半年,向日本药品和医疗器械管理局(PMDA)递交一线和二线治疗ESCC患者的上市申请
预计将于2024年第一季度,向EMA递交一线治疗不可手术、局部晚期或转移性G/GEJ腺癌的上市申请
Zanidatamab2
与Jazz Pharmaceuticals和Zymeworks合作,预计将于2024年下半年向NMPA递交一项治疗HER2扩增的不可手术和晚期或转移性胆管癌的上市许可申请(BLA)
预计临床进展
Sonrotoclax
预计将于2024年第二季度完成一项潜在可用于注册的全球2期试验的入组工作,用于治疗R/R MCL
欧司珀利单抗(抗TIGIT抗体)
预计将于2024年第一季度,完成3期AdvanTIG-302试验的入组工作,用于一线治疗NSCLC
Tarlatamab3
(靶向DLL3和CD3的双特异性抗体T细胞接合器)
与安进公司合作,预计将于2024年下半年,在中国启动一项用于治疗局限期小细胞肺癌的全球3期试验的入组工作
早期研发
预计将于2024年,启动至少10个新分子实体的首次人体临床试验,包括泛KRAS抑制剂、MTA协同PRMT5抑制剂、EGFR降解剂、CDK2抑制剂、ADC 和双特异性免疫细胞衔接器
与安进公司合作3,预计将于2024年上半年在中国入组首例患者,推进xaluritamig(AMG 509,靶向STEAP1和CD3的XmAb® T细胞衔接分子4)用于治疗转移性去势抵抗性前列腺癌的1期研究



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57