美国专利商标局(USPTO)的专利审查与上诉委员会(PTAB)于2024年1月16日作出授权后重审(Post Grant Review)决定(PGR2021-00030),宣告美国Seagen公司(下称SGI)的US10808039B2(后称“039专利”)的权利要求1-5,9和10无效。该决定是日本第一三共制药(下称DSC)和SGI长达三年的专利拉锯战中的重大转折,它意味着笼罩DSC明星ADC药物Enhertu(DS-8201,通用名:德曲妥珠单抗)的专利侵权疑云即将被扫清。
DSC和SGI围绕Enhertu所开展的商事仲裁、授权后再审程序(PGR)以及专利侵权诉讼对于国内生物医药创新主体具有宝贵的借鉴意义,笔者将从合作研发的衍生技术归属、专利无效、以及诉讼程序博弈三个方面为读者分析该系列案。
一
避免合作研发的通病——衍生技术的知识产权归属争议
DSC与SGI的039专利纠纷源自ADC药物Enhertu的利益分配,Enhertu的活性成分是临床试验编号为DS-8201的药物分子,这是将抗HER2单克隆抗体Herceptin与拓扑异构酶I抑制剂通过基于四肽GGFG的接头共价连接而成的抗体药物偶联物(ADC),具体结构如图1所示。
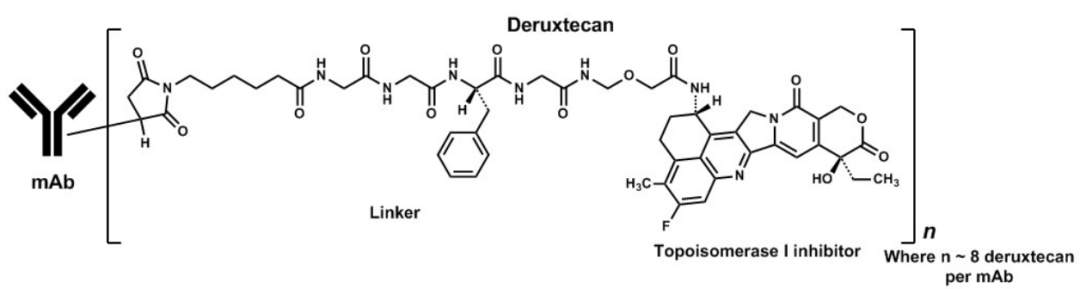
图1
该药物的诞生离不开DSC在与SGI合作研发七年中奠定的技术基础。2008年7月,DSC与SGI签订合作协议,DSC由此获得了SGI的相关ADC技术的使用授权,包括被SGI称为Firestone Linker的偶联接头技术,具体是用于ADC的“一种半胱氨酸抗体连接器单元、一种蛋白酶可切割的氨基酸单元以及任选地一个或两个自毁型间隔子”(在图1标识为Linker的大括号结构中,按从左至右的顺序依次为连接器单元、GGFG四肽构成的氨基酸单元和间隔子)。
双方在合作协议中约定,由SGI的药物缀合技术所衍生的技术及其相关权益都应归属于SGI所有。针对“药物缀合技术”,协议约定了其是指如下三类:
(a)细胞毒素或细胞抑制性化合物,如单甲基奥瑞斯汀E(monomethyl Auristatin E)和单甲基奥瑞斯汀F(monomethyl Auristatin F)及其某些变体、衍生物、类似物和盐,以及制备和使用这些细胞毒性或细胞抑制性化合物的方法;
(b)用于将上述细胞毒性或细胞抑制性化合物连接到抗体上的组合物和方法;以及
(c)SGI根据研究计划向被许可方提供的任何相关测定和方法。
此后,DSC在合作期间独立申请了以JP2012-225887(下称887申请)为优先权的PCT国际申请(优先权日2012年10月11日,公开日2014年4月17日),主要保护基于四肽GGFG而设计的ADC接头及相应缀合物,该申请的半数发明人在合作期间能够接触到SGI的Know-how。2015年6月,双方终止合作。同年9月,DSC启动了DS-8201的I期临床试验,并于次年披露了良好的试验结果。2019年1月,DSC顺利启动了III期临床,并迅速就DS-8201的全球开发和商业化合作与阿斯利康达成协议,交易总额高达69亿美元。此项巨额交易终于引起了SGI的注意和调查,并在同年(2019)7月提交了039专利的申请,在11月提起商事仲裁。在仲裁请求中,SGI主张DSC没有遵守合作协议中关于衍生技术归属的约定,并对使用了Firestone Linker的DS-8201分子主张相应权益。
虽然SGI看似在协议约定、化合物结构、发明人组成、研发顺序等方面都处于有利地位,但终裁决定却全面支持了DSC一方。DSC赢得仲裁主要在于两点:
一是将合作协议中的“药物缀合技术”进行了狭义解释。DSC基于SGI的毒素部分研发思路,特别是协议签订时SGI的全部管线和授权专利都仅限于奥瑞斯汀类化合物的事实,再结合合同解释的原则,使仲裁员认定合作协议中的“细胞毒素”不应解释为任意类别,而应限定在“如(such as)”之后的具体例子,即,奥瑞斯汀类化合物及其衍生物或盐。基于该解释,使用喜树碱类化合物DX-8951作为毒素部分的DS-8201不应属于SGI衍生技术的范畴。
二是明确了DS-8201中的接头在切割后将产生有别于Firestone Linker的结构,从而成功地主张了DS-8201和Firestone Linker分属两类不同的接头。具体而言,DS-8201中接头的间隔子羟基乙酰基切割后仍将结合在毒素部分DX-8951上,构成最终有效载荷(payload)的一部分,应视为非无痕型(non-traceless)接头;而Firestone Linker在切割后没有取代基残留,属于无痕型(traceless)接头。
不论中外,衍生技术的归属争议一直是合作研发中的常见问题。通过梳理上述仲裁过程,笔者对该问题的思考和建议如下:
首先,要增加合作研发协议签订过程中技术人员的参与度。如果仅从法律文书措辞的角度来看,使用“如”示例细胞毒素,使用“这些”、“上述”等词明确子条款之间的关联似无问题,但如果从技术角度(即ADC分子的各部分之间具有积木搭建式的特点,以及ADC分子的常见规避设计)出发,就要警惕这些关联性描述可能产生的不必要限制,使一些本来可以主张为常规部分替换和构件搭配的技术点成为规避设计的突破口。由于法律思维和技术思维有不同的理解角度,导致合作开发合同、委托开发合同和许可合同出现争议的案例并不鲜见。因此,建议技术人员,最好是同时掌握法律和相关技术的IPR或专利律师,参与此类合同的拟定和审核过程。
其次,合作往往孕育着未来的竞争对手,应保持警醒,未雨绸缪。从研发时间线来看,不排除DSC构造DS-8201分子实体可能在其与SGI合作的时间框架内。如果SGI保持足够的警惕,至少能够在887申请的公布日(2014年4月17日)觉察到潜在风险。由于此时仍处在合作期,SGI仍有时间和空间操作和调整其衍生技术的范围,从而避免落入失去分享权益的境地。这提示创新的专利监控名单不应局限于竞争对手,合作者也应当列于观察对象。
第三,DSC的一系列操作是技术接收方的优秀示范。从DSC在仲裁中的表现来看,其在合作协定中的技术划界、风险规避、对技术提供方的专利梳理、以及药物分子规避设计中都倾注了大量心血,才使得自研分子DS-8201从衍生技术中剥离出来,进而获得独有专利的最优结果。
合作研发是国内外生物医药创新主体都颇为倚重的一种研发模式,SGI与DSC系列案为国内创新主体提供了宝贵一课。
二
善用专利无效,突破量身定制型专利的围堵
039专利是基于美国申请号US10983340的第七个续案,在它之前,US10983340有四份优先权,并在美国先后提交了六件分案和续案(详见图2)。
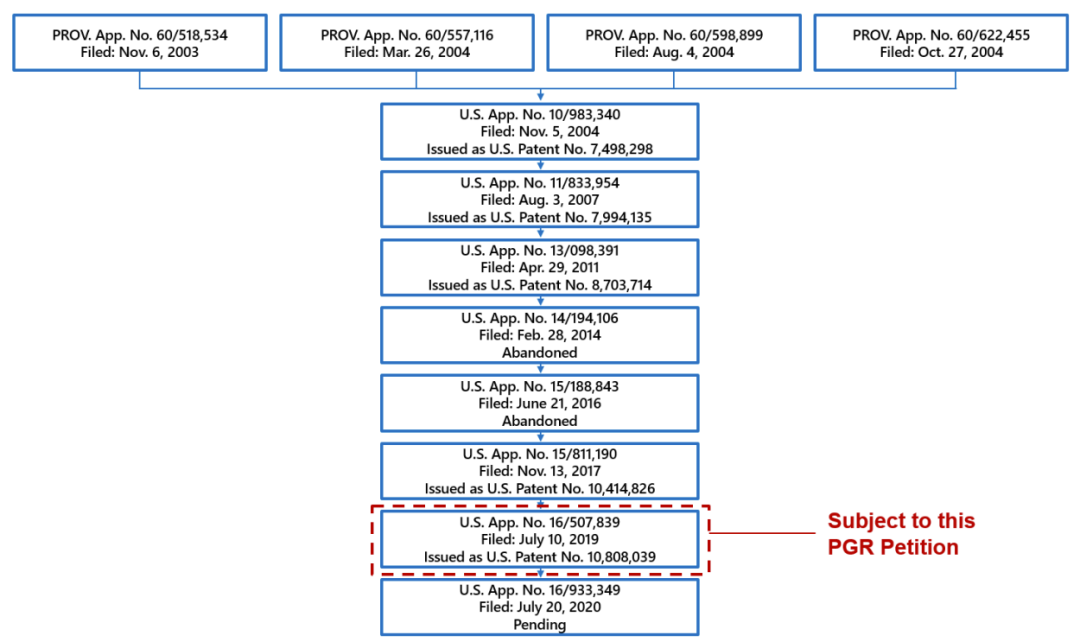
图2
如图2所示,039续案是在DS-8201的III期临床试验启动后的半年内提交(2019年7月10日),距离最早优先权日(2003年11月6日)已有16年之久。这样的超长待机申请是美国分案和续案制度的特有产物,也已经对我国创新主体的出海造成了实质性困扰。图3显示了039专利保护的马库什通式;其中,药物分子中的抗体部分、细胞毒素部分和接头中的肽片段分别用符号Ab、D和Ww表示。
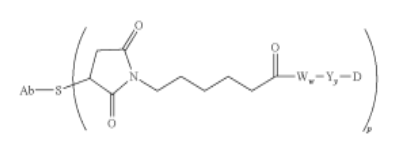
图3
与它之前的所有分案和续案相比,039专利的通式出现了明显的结构调整,尤其表现在:(1)对细胞毒素部分(D)几乎不作限定,而之前的申请都将毒素部分限定为奥瑞他汀类衍生物(auristatins),(2)首次限定了接头肽片段(Ww)仅限由甘氨酸和/或苯丙氨酸构成的四肽,之前则一般限定为0至12个任意氨基酸种类组成的寡肽。039专利的马库什通式是在已知DS-8201结构的基础上,以事后诸葛亮的方式从母案申请中拼凑得到的,显而易见,039专利是SGI为了将DS-8201涵盖其中而量身定制的专利。
这一做法已成为生物医药领域的美国专利权人的惯用手段,不论是在笔者曾经撰文讨论过的索非布韦化合物专利无效案[1],还是在前段时间引起热议的艾伯维狙击泽布替尼出海中,针对他人上市药物量身定制的专利续案都在其中扮演着核心角色。而PTAB在无效这类专利中传递出的价值导向则对于今后破题具有参考意义。
结合多个案例,笔者认为,PTAB对这类专利普遍持有审慎地否定态度。就本案的039专利而言,PTAB认为该专利在书面描述(written description)、可实施性(enablement)和创造性这三个方面均不符合美国专利法规定的授权要件。这三个条款也是无效这类专利的强大武器。
书面描述(WD):该条款大致相当于中国专利法中的说明书公开充分条款(中国专利法第26条第3款)。PTAB关于该条款的评述围绕Ww所示的“四肽”结构展开,重点在于论证说明书缺少“丛林路标(blaze mark)”,导致本领域技术人员不能从大量氨基酸的排列组合中,明确得出“仅由甘氨酸和/或苯丙氨酸组成的四肽”以及基于所述四肽的ADC方案。
在关于索非布韦无效案的文章中,笔者已经详细探讨了重新概括的马库什通式因适用WD条款而被无效的法理分析和实操建议,在此不予赘述。简而言之,对马库什通式采用“整体式”解读是这类重新概括的马库什通式难以符合WD规定的主要原因。
另一方面,如果从专利布局的角度出发,为了满足WD要件,则应高度重视现有技术检索和初始申请文件的撰写,通过设置丰富和有代表性的效果例以及多层次的马库什通式,尽量缩小规避设计的可能性。同时也要注意针对审查意见的答复和修改,避免出现禁止反悔的情形。
可实施性:该条款大致相当于中国专利法中的权利要求应该得到说明书支持的条款(中国专利法第26条第4款)。PTAB关于可实施性的论述更侧重于ADC分子的整体结构和效果,具体认为从说明书给出的效果例(仅涉及奥瑞他汀类化合物、且并未使用上述四肽的ADC分子)出发,本领域技术人员无法预见使用其他细胞毒素和肽类接头的ADC分子也能实现同样的技术效果。
结合笔者多年的审查经验,PTAB在审查可实施性条款时的结论正在与我国审查标准趋同,这一趋势已经体现在近年来多个重大美国判例的审理中[2],这样的审查标准对于无效请求方更为有利,反过来也将有利于创新水平的整体提升,因为开拓性发明仍将获得相对大的保护范围。
国内近期的生物序列无效决定可以作为示例。以PCSK9 iRNA组合物专利无效案为例[3],请求人主张更换配体后的siRNA-配体缀合物的靶向抑制效果不可预测,故得不到说明书支持,专利复审和无效审理部对此认为,“(本专利)要解决的主要技术问题是找到抑制效果好的siRNA序列及修饰形式,并不意味着本专利要实现发明目的只能使用该(示例性)配体”,“请求人也认可二者存在各自的功能,即配体在分子中起的作用是转运siRNA到靶组织细胞内,而siRNA的功能是沉默目标基因,因此,二者存在相对的独立性,即存在相互搭配以及替换的可能”,因而认定专利有效。该案中,专利权人取胜的关键在于,其将首要发明点划界在选取特定siRNA序列上的做法获得了合议组的认可。而这一划界是通过逐步论证共价缀合物分子的可拆分性、各构件有别于彼此和整体分子的技术贡献、以及次要构件的替代手段的可得性和可预见性来实现的。
需要注意的是,不同于实质审查程序,在无效审查阶段可实施性条款(支持条款)的审查都偏重于证据,一味强调效果不可预见性的做法并不可取。
优先权和新颖性:PTAB还认为039专利不具有新颖性,主要在于其优先权不成立,导致现有技术范围扩大,以至于涵盖了发明人在后发表的文献。这也是马库什通式化合物的分案和续案中的常见问题,例如前文提到的用于狙击泽布替尼的艾伯维专利,以及该公司针对乌帕替尼的中国专利等。在乌帕替尼无效案中(第562232号无效决定)[4],权利要求中的特定化合物结构未被记载在优先权文件中,导致乌帕替尼及其组合物不能享有优先权,从而被公开在优先权日和申请日之间的P类专利文献破坏创造性。需要指出的是,该P类文献也是艾伯维公司申请的。这表明,如果没有合理地布局,尤其是没有合理设计马库什通式,没有把控好接续申请之间的效果区别,将影响申请的授权及稳定性。
如国内药企尝试出海美国,应提前做好被这类“定制专利”围追堵截的准备,因为美国特有的分案/续案制度是培育这类专利的沃土。企业应当更加重视专利自由实施(FTO)尽职调查和专利监控,这样不仅可以节省巨额的跨国诉讼成本(本案仅律师费就超过4200万美元),也可以加快出海步伐,提高议价能力。
三
审时度势——捕捉和创造诉讼制胜的时机
前两节分别讨论了DSC和SGI之间争夺衍生技术权属的商事仲裁和攻击039专利有效性的授权后再审的实体内容,系列案件的全景是双方还在两个州法院进行专利侵权诉讼和无效反诉,上述三个程序彼此纠结、相互影响,构成了复杂的攻防战。笔者先归纳了法院诉讼和PTAB再审相关的主要事件和时间节点,详见表1。
表1

由表1可见,在被SGI起诉后,DSC先向地院反诉039专利无效,再向PTAB申请启动授权后再审(PGR)。并且,在申请PGR时,DSC还以SGI的侵权起诉基础不清楚为由,将039专利的10个权利要求拆分成两组分别提起PGR,即针对权利要求1~5、9~10的030 PGR和针对权利要求6~8的042 PGR,但均被PTAB以存在平行诉讼为由拒绝立案。
随着侵权诉讼的进行,SGI主动放弃了基于权利要求6~8的侵权主张。同月,DSC再次请求启动两项PGR程序,并请求移交判例意见小组(POP)[5]审核,PTAB同意其相关主张,即,权利要求6~8涉及的平行诉讼已经消除,且“有可能(more likely than not)”因可实施性和新颖性问题而被无效,因而准许042 PGR立案。同时,将030 PGR作为关联案件一并准许立案。
SGI立即放弃(disclaimer)权利要求6~8,并请求PTAB对042 PGR程序作出不利判决(adverse judgement)结案。与此同时,SGI对030 PGR的立案决定提出异议,认为平行诉讼尚在进行中,不符合立案条件。PTAB支持了SGI的主张,以不利判决结案042 PGR,并再次驳回了030 PGR的立案。
在PTAB驳回立案的4天后,Texas州法院在一审判决中判定039专利的权利要求1~5、9~10有效,DSC专利侵权成立,判罚4182万美元(后再追加8%权益金)。此时,距双方纠纷发生已近三年,DSC在仲裁、诉讼和专利授权后再审程序中尚未取得任何有利的实质性结果(此时距获得仲裁结果还有16个月),整体境况极度不利。
DSC第三次请求PTAB启动030 PGR,并引用2022年6月21日新发布的PGR指导备忘录利[6],强调PGR程序启动的关键在于是否存在“有说服力的无效证据(compelling evidence of invalidity)”,而不应由于存在平行诉讼而一概否认。
最终,PTAB启动了030 PGR,并在11个月内作出了与州法院判决完全相反的再审决定,判定039专利的权利要求1~5、9~10无效。
上述内容是笔者围绕双方攻防博弈的核心之一(启动PGR审查)所截取的相关事件,攻防双方都为国内创新主体提供了值得参考借鉴的诉讼策略选择。
关于DSC:
专利权是专利侵权诉讼的基础,虽然美国允许在侵权诉讼中由法院直接审理专利权有效性,但对于专业性较强的技术领域(如本案),陪审团很难具备准确理解技术内容、确定客观事实的知识水平。为此,本案中,DSC虽然向法院提出了专利权无效的反诉,但仍坚持通过PGR程序将PTAB的专业性意见引入本案。这也是很多复杂专利的被控侵权人所采取的应对方式。
然而,在反诉无效的同时或之后,提出PGR或者IPR(双方复审),就可能出现本案中PTAB因平行诉讼而拒绝立案的情形。这里不得不提及美国专利局规制平行程序重复审查的相关规则变化。NHK诉Intri-Plex和Apple诉Fintiv两件先例判决[7]确立了六类NHK-Fintiv因素,分别是(1)法院准许诉讼中止的可能性;(2)法院判决与PTAB决定的预计期限的接近程度;(3)法院和当事方对平行程序的投入;(4)平行程序中各自主张和事实的重叠程度;(5)平行程序中的当事人的相同程度;及(6)案情等其他兜底性因素。这六类因素并不涉及对可专利性的判断。在2019至2021年间,大量存在平行诉讼的PGR和IPR立案请求因Fintiv因素被驳回,驳回率峰值一度接近50%[8]。对此,美国专利局局长签发指导备忘录,将PGR立案的判断标准倒回至以可专利性的判断为重。就本案而言,DSC的首次PGR立案请求发生在2020年底,正是Fintiv因素阻止立案的峰值阶段。可能正是出于难以立案的预判,DSC做出了将039专利拆分为两个PGR这一非常规举措。事实证明,这一拆分干扰了SGI的诉讼思路,为DSC赢得了争辩空间和时间,最终等到了立案标准的重大调整。实际上,在最初被驳回立案之后,DSC就不断向PTAB提交大量其向学术界和产业界征询的建议,其中部分关于PGR立法本意和启动条件的观点与指导备忘录不谋而合,备忘录的快速诞生也许有DSC贡献的智慧和努力。
DSC对039专利的拆分很可能不是随意的。039专利只有一个独立权利要求,限定了ADC分子的马库什通式结构和可切割活性;从属权利要求2~5、9~10递进地限定了不同的子马库什通式,从属权利要求6~8则分别限定了ADC分子具有不同的功能。DSC”恰好”将功能性限定的权利要求6~8拆分为新的PGR。笔者推断,有一种可能性是DSC根据被无效的可能性高低进行划分,使得因功能性限定而易于被无效的权利要求6~8成为启动PGR的突破口。
DSC不是美国本土企业,但它在这场专利战役中不仅表现出对美国专利政策的深度了解和运用,还表现出主动创造有利条件的决心和毅力,这是打赢这场硬仗的主要因素。
关于SGI:
在上述案情中,SGI的整体表现中规中矩。但考虑到它只是一家创立于1998年的生物技术公司,能够与体量和专利诉讼经验远胜自己的DSC打得有来有回,甚至一度占据上风,已属不易。
SGI也明确认识到,法院判决可能更有利于专利权人,因此不遗余力地阻止PGR程序启动。它对Fintiv因素的利用非常成功,甚至能够在PTAB已经认为权利要求6~8存在无效可能性的不利情况下,迅速通过不利判决终止042 PGR,并通过Fintiv因素再次成功说服PTAB驳回030 PGR的立案。因此,如果不是美国专利局调整立案标准,SGI很可能实现阻止PGR启动的目的。
虽然039专利被PTAB宣告无效,但该决定尚未生效。考虑到SGI还有围绕DS-8201设计的新续案,如果SGI不针对030 PGR的无效决定上诉,则续案也难以获得授权。因此,即使目前关于可实施性和优先权等的审查标准对039专利不利,但SGI仍有可能坚持上诉。特别是在辉瑞于2023年12月底完成对SGI的收购之后,本案的走向和结论有可能影响到两大制药巨头在ADC赛道上的细分,值得进一步关注。
国内生物医药领域的专利诉讼数量有限,像本案这样多个法律程序并行的专利争议更加罕见。对于迟早出海搏击的国内药企而言,通过该案可以领略美国专利诉讼复杂性和精彩程度。当事双方的表现可圈可点,可供参考借鉴,尤其是被控侵权方通过PGR决定实现绝地反转,PTAB充分展现专业优势和远高于法院的审查效率,专业人员在此类大型复杂诉讼中起到的不可替代的重要性。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57