“专利悬崖”是制药领域所特有的现象,意指药品专利保护期届满后,其销售额与利润大幅下滑的现象。此种现象如同一道无形的悬崖,令众多原研药品难以逾越。对于原研药企而言,在寻求新的增长点与巩固专利护城河的过程中,均面临着诸多挑战。即便是在光辉的成就之下,亦无法回避这一严峻现实。
近日,知名行业媒体FIERCE Pharma发布了2024年将失去美国专利保护的十款产品名单。
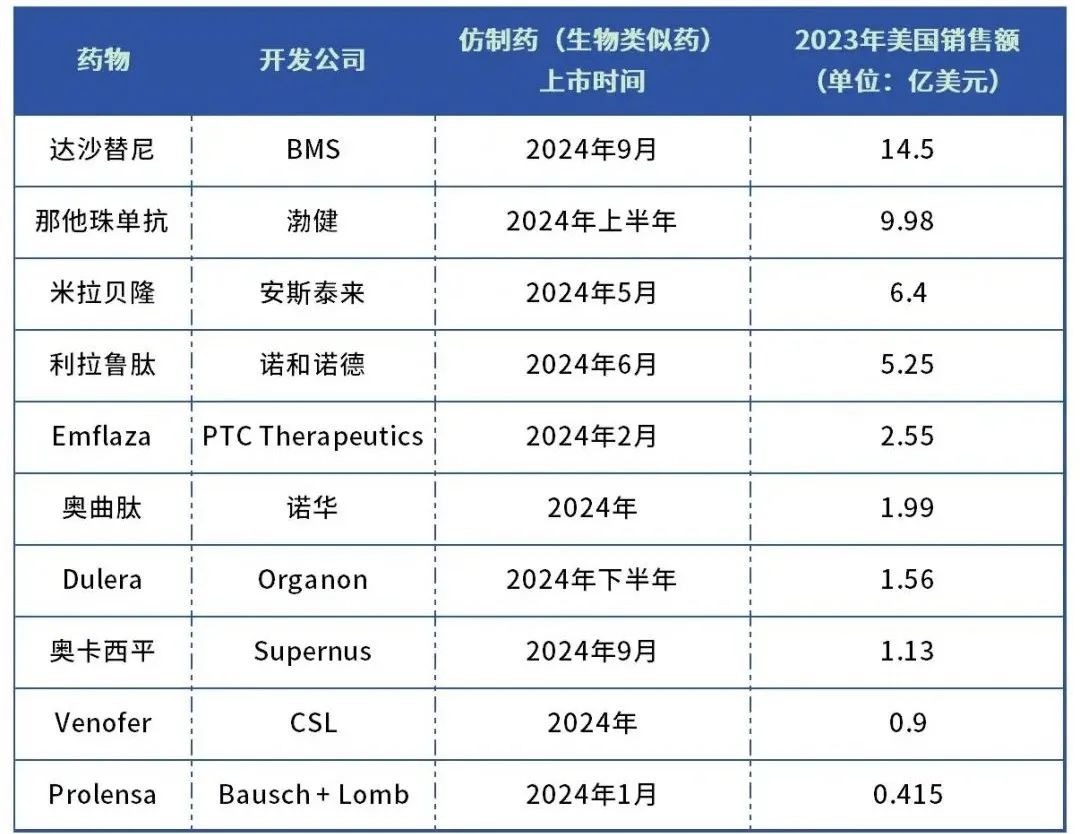
表:2024年在美专利到期的十大药物
数据来源:FIERCE Pharma
1
Sprycel (达沙替尼)
适应症: 慢性粒细胞白血病
研发企业: BMS
2023年美国销售额:14.5 亿美元
生物类似药上市时间:2024年9月
Sprycel(达沙替尼)是百时美施贵宝(BMS)肿瘤学主打产品之一,是一种针对癌细胞中特定蛋白质并阻止癌细胞生长的药物。
Sprycel于2006年首次获FDA批准,用于对先前治疗药物(包括伊马替尼)具有耐药性或不耐受的费城染色体阳性慢性髓系白血病慢性期(Ph+CML-CP)成人患者以及用于对先前治疗药物具有耐药性或不耐受的Ph+ALL成人患者。
BMS发言人在电子邮件中表示,Sprycel为慢性髓性白血病(CML)领域带来了巨大的创新, 显著提高了CML患者的生存率。
BMS在一份年度证券文件中解释说,由于与Apotex和一些未披露名称的公司达成了和解协议,某些仿制药获准在2024年9月上市,或在某些情况下提前上市。
除 Apotex 公司外,该公司在文件中没有透露达成Sprycel 专利和解的公司名称。同时,根据这份文件,BMS 还有多起关于其他仿制药的诉讼正在审理中。
根据 BMS 最近的一份财报,2023 年Sprycel 全球销售额约为19.3 亿美元。其中,14.5 亿美元来自美国。
根据该机构的记录,到目前为止,Biocon、Lupin、Dr . Reddy's Laboratories、Alebmic和Teva的仿制药已获得 FDA 的暂定批准。
2
Tysabri (那他珠单抗)
适应症: 多发性硬化症、克罗恩病
研发企业: Biogen
2023年美国销售额:9.98亿美元
生物类似药上市时间:2024年下半年
Tysabri 于2004年获得美国 FDA 批准用于治疗多发性硬化症,2008年获批用于治疗克罗恩病。该药在 2009 年达到了畅销药的水平,销售额高达11亿美元。
根据渤健(Biogen)发布的2023年第四季度财报,2023年该药在美国的销售额为 9.98 亿美元,较2022年的 11.2 亿美元下降了约 11%。
在特拉华州联邦法院驳回百健对山德士(Sandoz)的专利侵权诉讼约两个月后,山德士于2023年8月获得了美国首 个、也是迄今为止唯一一个Tysabri生物类似药的批准。
3
Myrbetriq (米拉贝隆)
适应症:膀胱过度活动症
研发企业:安斯泰来
2023年美国销售额:6.4亿美元
生物类似药上市时间:2024年5月
2012年6月,Myrbetriq 在美国获批上市。
2023年 6 月,美国特拉华州地区法院作出裁决,宣布该药 2030 年的一项关键专利无效,这促使安斯泰来公司公开回应,并强调该药在 2024 年 5 月前仍受专利保护。
不久之后,安斯泰来公司又获得了一项 2030 年的膀胱过度活动症药物专利,并发起了新一轮针对仿制药公司的诉讼。安斯泰来寻求获得FDA禁令,禁止生物类似药在该专利到期前上市。
FDA 的桔皮书显示,Myrbetriq 的监管专属期将于 2024 年 9 月到期。该药的部分专利将于 2024 年 5 月到期。
与此同时,Lupin和Alkem两家公司的 Myrbetriq仿制药已获得 FDA 批准,此外,Aurobindo 的仿制药也获得了初步批准。
2023年Myrbetriq在美国的销售额达6.4亿美元。
4
Victoza (利拉鲁肽)
适应症:2型糖尿病
研发企业:诺和诺德
2023年美国销售额:5.25亿美元
生物类似药上市时间:2024年6月
作为诺和诺德第一代GLP-1糖尿病药物,利拉鲁肽自2010年获批以来已顺利享受了14年的独占期,包括将其专利悬崖延长至2024年的儿科独占期。目前,生物类似药竞争者Teva、Viatris 和Sandoz正急于蚕食利拉鲁肽已经日薄西山的销售额。
根据诺和诺德2023年的年度报告,2023年利拉鲁肽在美国的销售额为5.25亿美元,较2022年9.3亿美元大幅下降。
根据美国证券交易委员会的一份文件,Teva、山德士和晖致(Viatris)为主要的仿制药公司。其中,Teva计划在 2024 年 6 月推出利拉鲁肽生物类似药。该公司在2017年将其生物类似药提交审批后,2019年与诺和诺德达成了和解协议,并在法庭上展开了激烈的交锋。
5
Emflaza (deflazacort)
适应症: 杜氏肌营养不良症
研发企业: PTC Therapeutics
2023年美国销售额:2.55 亿美元
生物类似药上市时间:2024年2月
在经历了之前的定价争议之后,PTC Therapeutics 获批治疗杜氏肌营养不良症(DMD)的关键药物 Emflaza 已经面临着新的生物类似药竞争。
印度的 Aurobindo 公司在2024年2月获得FDA 的最终批准后,正在计划推出Emflaza 生物类似药。该药的标签范围涵盖了 5 岁及以上患者。
PTC 在其第四季度和全年财报新闻稿中表示,2023年 Emflaza 在美国的销售额达到 2.55 亿美元。
6
Sandostatin LAR (注射用醋酸奥曲肽微球)
适应症:肢端肥大症,类癌瘤引起的严重腹泻
研发企业: 诺华
2023年美国销售额:1.99 亿美元
仿制药上市时间:2024年
Sandostatin LAR 于1998 年首次获得FDA批准治疗肢端肥大症,还可用于治疗转移性类癌引起的严重腹泻和潮红。
Viatris 总裁Rajiv Malik在今年 1 月举行的摩根大通医疗保健会议上表示,将Sandostatin LAR列为今年计划推出的仿制药之一。
根据Viatris 公司最新消息,Sandostatin LAR 仿制药申请正在接受 FDA 审查,并被列为其今年发布的重点新产品之一。
虽然Sandostatin LAR此前一直保持着美国的独家经营权,但其销售额已逐年大幅下降。去年Sandostatin在美国的销售额为1.99亿美元,同比下降2%。
7
Dulera (糠酸莫米松+福莫特罗)
适应症: 哮喘
研发企业:Organon
2023年美国销售额:1.56 亿美元
仿制药上市时间:2024年下半年
Dulera是一款皮质类固醇糠酸莫米松和长效β受体激动剂福莫特罗的复方制剂,通过吸入器给药。Dulera 曾被视为潜在的重磅炸 弹,2010 年获批用于治疗哮喘,但 2012 年治疗慢性阻塞性肺病(COPD)的第二次申请遭 FDA拒批。
尽管获批折戟,但其销售额仍呈上升趋势,2015年达到5.36亿美元的峰值。到2017年,由于价格竞争压力以及需求下降,Dulera的销售额缩水至2.87亿美元。2023年更是骤降至1.56亿美元。
Dulera已于2020年失去了在美国的专利保护,但至今未有相关仿制药上市。
印度仿制药巨头Lupin曾于2020年4月向FDA递交了Dulera仿制药的上市申请,但其申请在2022年底被FDA拒绝批准。上个月,该公司表示将在2024年5月之前对FDA的决定做出回应。
8
Oxtellar XR (奥卡西平)
适应症: 癫痫
研发企业:Supernus Pharmaceuticals
2023年美国销售额:1.13 亿美元
仿制药上市时间:2024年9月
2012 年,Oxtellar 作为辅助疗法获得批准后,其销售额逐年攀升。2019年,Oxtellar作为单药疗法获得批准后,销售额有所增长,2021年首次突破1亿美元,2023年在美国的销售额为1.13亿美元。
十年前,Actavis 和 TWi Pharma 就已首次对 Oxtellar 发出仿制药挑战。Supernus分别于2017年和2018年在针对仿制药生产商的侵权案中胜诉,因为法院判决其专利期有效至2027年。
Oxtellar XR 失去专利保护对公司的影响并不大。在2月份的季度电话会议上,Supernus 首席执行官Jack Khattar表示,预计仿制药竞争要到9月份才会开始,补充道2024 年 Oxtellar XR 和Trokendi XR的合并净销售额将在 1.25 亿美元到 1.35 亿美元之间。
9
Venofer (蔗糖铁)
适应症:慢性肾病患者缺铁性贫血
研发企业:CSL
2023年美国销售额:0.9亿美元
仿制药上市时间:2024年
Venofer于2000年获得FDA批准用于治疗慢性肾病成人患者的缺铁性贫血。
多年来,Venofer 一直在回击潜在的仿制药挑战者。2022 年 5 月,根据当时的一份季度报告,Viatris 认为其Venofer 仿制药有望在2022年上市。
与 Sandostatin LAR 一样,Viatris 相信它能在 2024 年改变这一局面。Viatris 在 2 月份的投资者推介会上称,其 Venofer 仿制药正在接受监管审查,这是一个率先上市的机会。
CSL 在 2021 年底以 117 亿美元收购 Vifor Pharma 时获得了该药。根据 CSL 的投资者报告,该药物2023 年的全球销售额为 1.8 亿美元。
虽然 CSL 没有按地域细分该药的销售额,但 2021 年,Venofer 在美国的销售额约占其在 Vifor 旗下全球销售额的二分之一。假设 CSL 旗下也有类似的销售细分,预计 Venofer2023年在美国的销售额约为 9000 万美元。
10
Prolensa (bromfenac)
适应症:白内障手术后的术后眼部炎症
研发企业:Bausch + Lomb
2023年美国销售额:0.415亿美元
仿制药上市时间:2024年1月
FDA于2013年批准Bausch + Lomb的Prolensa滴眼液作为白内障手术患者术后炎症的治疗药物,但它并不是第一款进入美国市场的含有非甾体抗炎药物溴芬酸活性成分的滴眼液产品。
Prolensa最初是由日本公司Senju开发,于 2000 年在日本上市。ISTA 公司于 2002 年获得了该药在美国的使用权,ISTA 后来被Bausch + Lomb收购。2005年,该产品在美国获批上市,商品名为Xibrom(溴芬酸0.09%),作为白内障手术后眼部炎症的每日2次滴眼液选择。2010年,ISTA开发的溴芬酸的每日1次滴眼液版本Bromday获批上市。
在Prolensa获得FDA批准的同一年,Lupin曾向FDA提交溴芬酸的仿制药上市申请。经历了长达近3年的诉讼后,Lupin仿制药于2023年11月获得FDA 批准。
除了Lupin之外,Metrics、Innopharma、Apotex和Paddock也向FDA提交了Prolensa的仿制药上市申请。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57