安进的Prolia/Xgeva(denosumab,地舒单抗)是一类与RANKL(核因子κB受体活化因子配体)蛋白结合的人单克隆抗体,其通过与RANKL蛋白结合发挥作用,以防止破骨细胞分解骨骼,旨在增加骨量和强度,用于治疗骨质疏松症、骨癌。
3月5日,FDA批准Jubbonti注射剂作为美国许可的Prolia的可互换生物仿制药,批准Wyost注射剂作为美国许可的Xgeva的可互换生物仿制药。两种生物仿制药与各自的参考药物具有相同的剂型、给药方案、给药途径和适应症。该产品也是FDA批准的第一款地舒单抗生物类似药。
并不是所有的生物类似药都是可互换的,FDA指出,被批准为可互换生物类似药产品意味着产品达到了可互换的标准。
这些标准包括:
可互换的生物类似产品与参照产品生物相似;
可互换的生物类似产品可预期在任何给定患者中产生与参照产品相同的临床结局;
在可互换生物类似产品和参照产品之间交替或转换的安全性风险或降低有效性的风险,不大于在没有这种交替或转换的情况下使用参照产品的风险。
本文将对地舒单抗生物仿制药基本情况及研究进展进行总结。
01
药物基本信息
1
Jubbonti(与Prolia相同)
处方剂量:1mlJubbonti含有地舒单抗60mg(60mg/mL溶液)、冰醋酸(1.021mg)、聚山梨酸酯20(0.1mg)、氢氧化钠(0.499mg)、山梨醇(47mg),和注射用水,pH为5.2。
适应症>>
绝经后骨质疏松的骨折高危女性人群;
骨质疏松的骨折高危男性人群增加骨量;
糖皮质激素诱导的骨质疏松的骨折高危人群;
接受去势治疗的骨折高风险的非转移性前列腺癌男性患者增加骨量;
接受芳香酶抑制剂辅助治疗的骨折高风险的乳腺癌女性患者增加骨量。
2
Wyost(与Xgeva相同)
处方剂量:1.7mlWyost含有地舒单抗120mg,冰醋酸(1.85mg),聚山梨酸酯20(0.17mg),氢氧化钠(0.91mg),山梨醇(78.9mg)和注射用水,pH为5.2。
适应症>>
多发性骨髓瘤和实体瘤骨转移患者骨骼相关事件的预防;
不能切除或手术可能导致严重并发症的成人和骨骼成熟的青少年的骨巨细胞瘤;
双膦酸盐疗法难治的恶性肿瘤引起的高钙血症。
3
临床效果
来自III期ROSALIA试验(NCT03974100)的数据支持了FDA的批准。该研究对527名患有骨质疏松症的绝经后妇女进行了地舒单抗生物类似药与参考药物(Prolia)的比较。研究受试者被随机分配接受生物类似药或参考药物,治疗时间长达78周。目的是在腰椎骨矿物质密度的变化,以及药代动力学和药效学方面证明两者的相似性。研究结果显示,地舒单抗生物类似药与参考药物相当。
此外,FDA审查了全面的临床数据包,I/III期综合研究结果证实,该生物仿制药在药代动力学、药效学、疗效、安全性和免疫原性方面,与参考药物在各自适应症方面相匹配,并证明了相似性,这是用于所有适应症互换的基础。
4
不良反应
在临床试验中观察到的Jubbonti&Wyost的副作用和不良事件与Prolia&Xgeva一致。与Prolia一样,Jubbonti最常见的副作用是低血钙、肌肉疼痛、普通感冒症状和关节炎。与Xgeva一样,Wyost最常见的副作用是疲劳、低血磷、腹泻、恶心、红细胞数量降低、血小板数量降低、血钙水平降低、背部疼痛、下肢或手部肿胀、上呼吸道感染、皮疹和头痛。
2024年1月19日,FDA发布了一份药物安全通讯更新报告,Prolia增加了一个黑框警告,警告晚期慢性肾病患者发生严重低钙血症的风险增加。与Prolia一样,Jubbonti在处方信息中也有一个黑框警告。
5
市场情况
原研安进开发的地舒单抗于2010年5月首次在欧盟获批上市。根据安进财报,2023年Xgeva和Prolia共收入61.6亿美元。不过,由于山德士正在就地舒单抗生物类似药进行专利诉讼,Wyost和Jubbonti目前还不能上市,山德士也未透露预期的上市时间以及其他上市细节。
02
国外研发申报情况
印度RelianceLifeSciences公司研发的R-TPR-045/DenosuRel于2022年2月1日获得印度药监局(CDSCO)批准,用于治疗骨转移和绝经期后骨质疏松。
SamsungBioepis公司的SB-16、Celltrion公司的CT-P41、以色列梯瓦制药工业有限公司的TVB-009、IntasBiopharmaceuticals公司的M05BX04、匈牙利吉瑞大药厂的RGB-14-P目前正处于Ⅲ期临床试验阶段,开发用于治疗绝经期后骨质疏松。
而Cephalon公司研发的CEP-37251因多种原因已经于2010年11月中止了Ⅰ期临床研究。
03
国内上市及在研情况
2019年5月21日,安加维(英文名Xgeva)获得国家药品监督管理局批准用于治疗不可手术切除或者手术切除可能导致严重功能障碍的骨巨细胞瘤。2020年11月20日,安加维在中国用于预防实体瘤骨转移及多发性骨髓瘤引起的骨相关事件(SRE)的新适应症上市申请,获得国家药品监督管理局的批准。
普罗力(英文名Prolia)于2020年6月获得NMPA批准,用于骨折高风险的绝经后妇女的骨质疏松症治疗。2023年2月,普罗力获得NMPA批准,用于治疗骨折高风险的男性骨质疏松症。
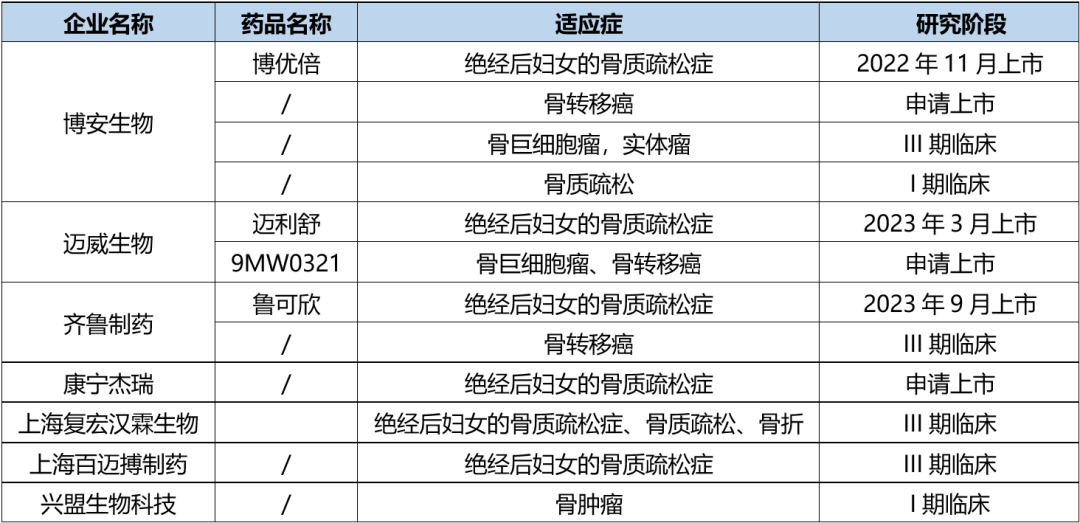
地舒单抗在临床应用中的反馈较好,据沙利文预计,2030年地舒单抗在中国骨质疏松的市场规模将达78亿元。庞大的市场引来诸多药企争相入局,目前,国内已有三家企业生物类似药上市,多家企业也在积极布局。以下表中列举了一些地舒单抗的研究进展。
表1.部分国内企业地舒单抗研发进展详情
总结
随着阿达木单抗、利妥昔单抗、地舒单抗等各类生物类似药在国内获批上市,我国生物类似药研发已进入高速增长阶段。据沙利文预计,我国生物类似药市场到2030年将达到589亿元。
地舒单抗生物类似药的开发,对于提高国内患者用药可及性、降低用药成本具有重要作用。然而,随着入局企业的增多,能在成本控制、产能提升上脱颖而出的企业才能拥有更强大的竞争力。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57