药包材即直接与药品接触的包装材料和容器,其作为药品的重要组成部分,本身的质量、安全性、使用性能以及药包材与药物之间的相容性对药品质量有着十分重要的影响。药包材一般是由一种或多种材料制成的包装组件组合而成,应具有良好的安全性、适应性、稳定性、功能性、保护性和便利性,在药品的包装、贮藏、运输和使用过程中起到保护药品质量、安全、有效、实现给药目的(如气雾剂)的作用。基于药包材对药品的重要作用,变更药包材可能对药品的理化性质、杂质谱、含量、稳定性、安全性等产生一定的影响,其风险取决于制剂的给药途径、药包材性能以及包装与制剂的相容性等,因此为了更好地确保药品质量与安全,药包材变更跟药品生产其他变更一样,需要科学的评估与管控,避免药包材变更给药物带来的安全性风险。


01
对于药包材生产企业而言:
药包材变更指用于已上市药品的药包材产品在生产过程中涉及原辅料、生产工艺、质量标准等方面发生的变更。药包材生产企业应根据《药包材变更研究技术指南》开展变更研究。对于技术类变更,药包材登记人应依据所生产产品用途的风险类别(高风险、非高风险)和变更项目,确定研究方案和项目并开展研究及验证,必要时根据研究结果调整研究内容和方案。
常见的技术类变更项目主要有:a)生产场地变更;b)原材料及配方变更;c)生产工艺和过程控制变更;d)质量标准变更;e)产品包装变更;f)有可能对药包材质量及其预期适用性产生影响的其他技术类变更。
变更研究的内容通常采用对比分析法,包括(但不限于):a)变更理由的相关文献资料检索和分析;b)产品质量标准、检验项目及检验数据的对比分析;c) 生产工艺和过程控制的研究及对比分析,包括灭菌(如适用);d)原辅料和添加剂的法规符合性,如美国CFR21相关添加剂内容、《欧洲药典》附录3.1等; e)包装材料自身稳定性的影响研究及对比分析,一般适用于塑料和橡胶等高分子材料,可参照相关技术指导原则进行;f)包装材料/组件的可提取物研究及对比分析;g)包装组件/系统的阻隔性能研究及对比分析;h)包装系统完整性的研究及对比分析;i)包装系统的功能性研究及对比分析;j)监管部门或制药企业有特殊要求或认为有必要的其他研究项目。
02对于药品生产企业而言:
已上市药品的药包材的变更包括已用药包材的改变、增加或去除等情形。其中,药包材的改变除了药包材生产企业在生产过程中发生变更外,还包括药品生产商更换包材品种或供应商等。
《药品上市后变更管理办法(试行)》第十七条指出生产设备、原辅料及包材来源和种类、生产环节技术参数、质量标准等生产过程变更的,持有人应当充分评估该变更可能对药品安全性、有效性和质量可控性影响的风险程度,确定变更管理类别,按照有关技术指导原则和药品生产质量管理规范进行充分研究、评估和必要的验证,经批准、备案后实施或报告。
国家药品监督管理局药品审评中心也按化学药、中药、生物制品等分类出台了相应的变更指导原则,也均涉及到了变更包装材料和容器,总体上指出,变更药品的包装材料和容器应能对保证药品的质量和稳定性起到有益的作用,不得对药品的保护性、功能性、安全性和质量产生不良影响。具体按变更可能对药品产生影响的严重性分为微小变更、中等变更、重大变更3类情况,具体如下:
变更包装材料和容器情形分类
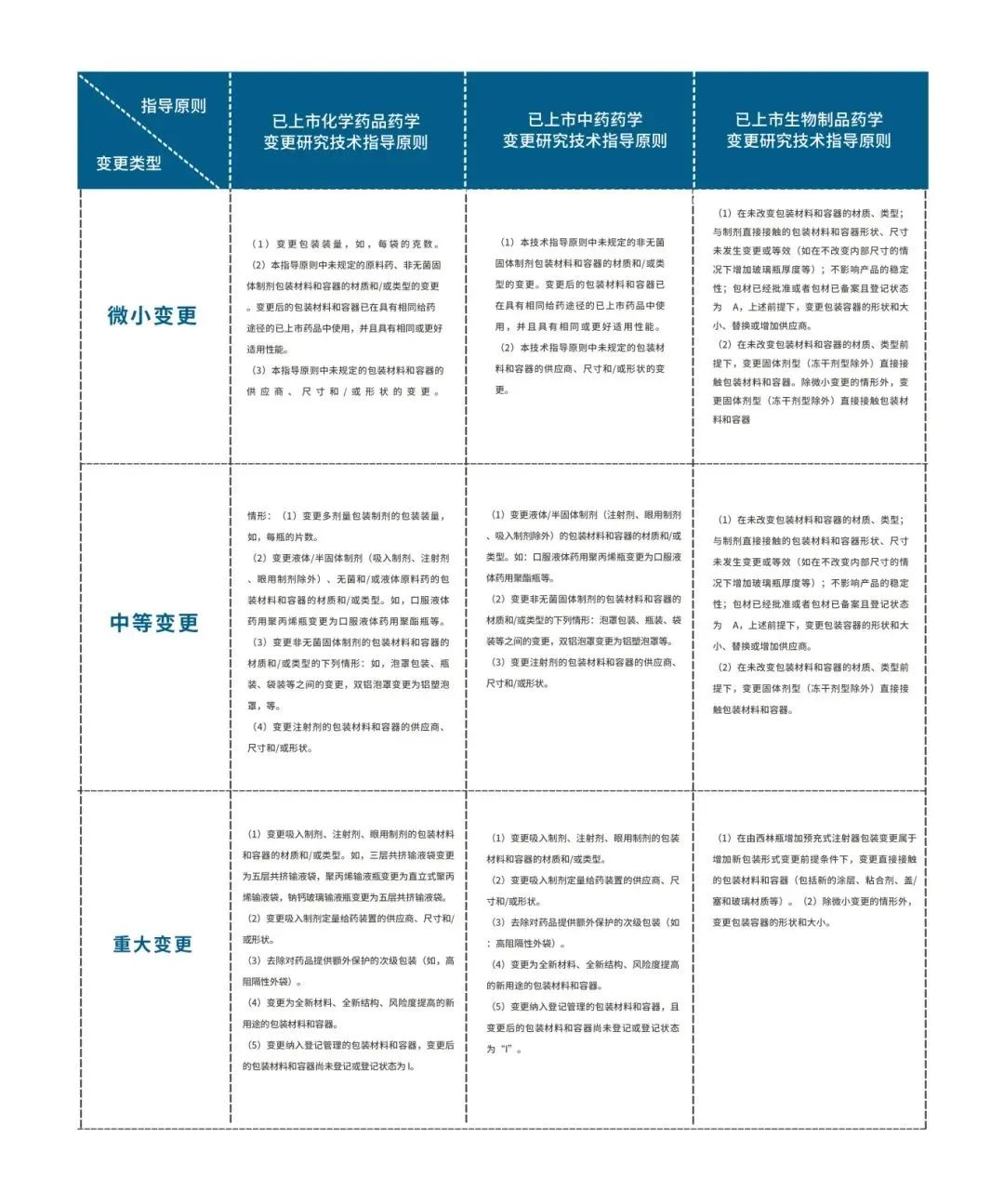
其中对于生物制品,当次级包材a)变更包装规格;b)在变更不与生产中重复发生的偏差或稳定性担忧相关及变更应不降低产品的质量和稳定性,不改变原包装系统的特性(例如包装系统具有防止儿童误打开的作用等),未涉及可能影响产品转运、使用和安全性的包材部分的前提条件下变更不与制剂接触的包材的任何部分也属于包装系统的微小变更。而次级包材变更内容为从外包装中去除稀释剂时,属于中等变更。
各指导原则还针对各类变更,药品生产企业需要进行的研究验证工作进行了详细阐述。其中研究验证工作中对于药包材的等同性/可替代性研究可参考《上市药品包装变更等同性可替代性及相容性研究指南》进行。总之,已上市药品的药品包装材料或容器/包装系统的变更,以及药包材生产企业在生产过程中发生变更的研究和评价,是药品生产企业和药包材生产企业维护药品全生命周期质量风险管理的重要内容。药品上市许可持有人及药包材登记人,需根据药包材变更研究和综合评估的结果,共同开展药包材变更的等同性/可替代性评价、药包材与药品相容性研究等工作,以确定药包材变更前后可能对药品质量带来的潜在风险,保障患者用药安全。
参考资料:
1.《药包材变更研究技术指南》
2.《已上市化学药品药学变更研究技术指导原则(试行) 》
3.《已上市中药药学变更研究技术指导原则(试行)》
4.《已上市生物制品药学变更研究技术指导原则(试行)》
5.《上市药品包装变更等同性可替代性及相容性研究指南》(TCNPPA 3019-2022)
6.《药品上市后变更管理办法(试行)》
关于江苏安莱博
江苏安莱博医药是一家综合性的药物研发技术服务CRO企业,业务开展始于2019年,专注药物和药包材分析技术为基础,以药物杂质制备及杂质分析、药包材分析及其注册登记一体化研究、小分子药物工艺开发及CMC研究、微生物研究及测试等领域为核心的业务板块,遵循cGMP体系规范,在苏州工业园生物医药产业基地设立了超4500m2+ 的研发和办公场地,实验室先后通过CNAS资质认可和CMA资质认定,P2实验室备案资质,运营期间并先后获得江苏省科技民营企业、苏州工业园区科技领军企业、国家高新技术企业称号为全球药物研发客户提供可靠、快捷的一站式研发服务解决方案,助理医药产业健康发展。
安:
安莱博医药致力于成为客户最值得信赖的合作伙伴,严格遵守国家药监局监管规定及要求,各子公司提供相关服务业务:
汇:
汇毓安莱博:药物杂质分析及测试、微生物测试、药用包材相容性研究及功能性测试等
信:
信维安生物: 仿制/创新药CMC研究服务、原料药工艺开发、药物制剂工艺开发、仿制药申报等
杰:
安莱杰生物:药物杂质对照品、原料中间体、杂质定制合成等服务



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57