近日,知名行业媒体Drug Hunter 发布了2023年度十大小分子药物名单,这些分子从上万篇研究文章中挑选而出。其中包括6款“first-in-class”药物以及首 款口服PCSK9抑制剂等。
表:2023年度十大“明星小分子”
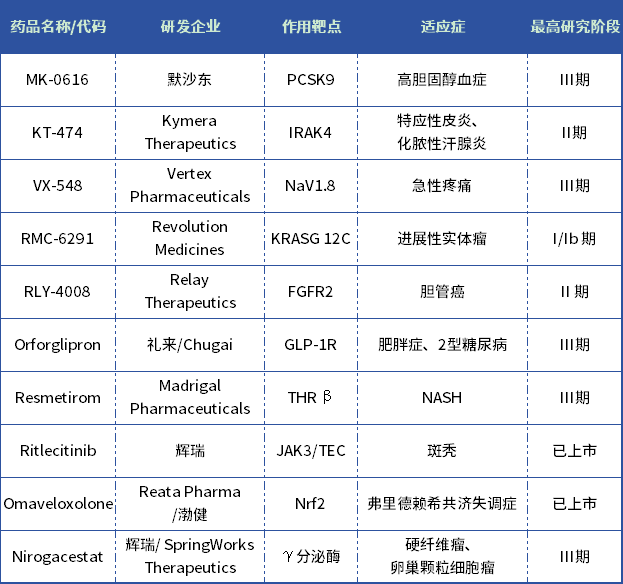
数据来源:Drug hunter
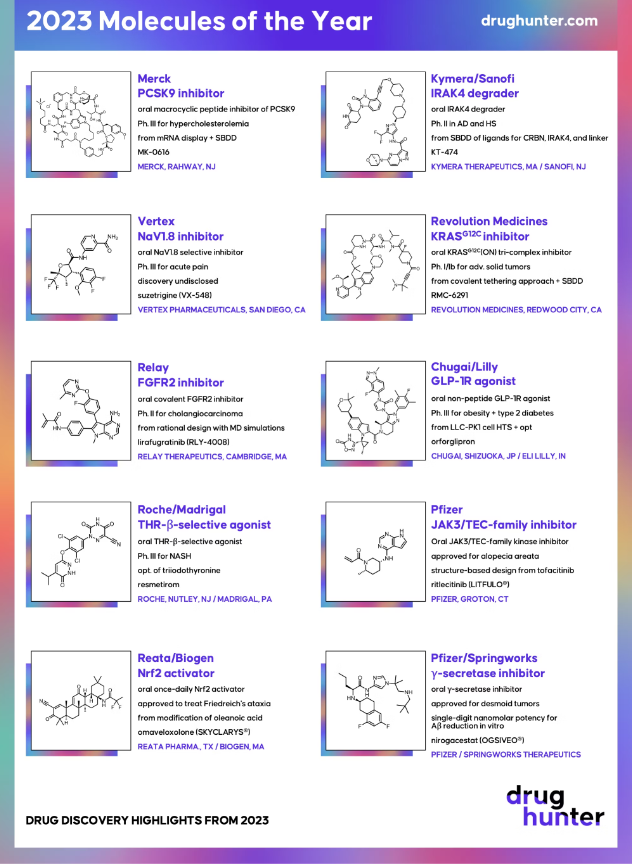
图:2023年度十大“明星小分子”
图片来源:Drug Hunter
1. MK-0616:
口服PCSK9抑制剂
研发企业:默沙东
适应症:高胆固醇血症
在研阶段:Ⅲ期
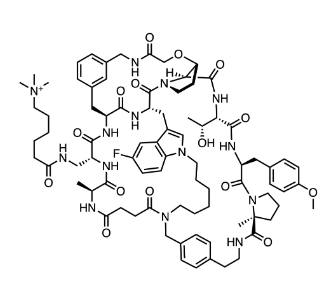
图:MK-0616分子结构式
图片来源:Drug hunter
MK-0616是一种突破性的口服PCSK9抑制剂,PCSK9在血液中循环中可与低密度脂蛋白受体(Low Density Lipoprotein,LDL-R)结合,形成复合体,最后被肝细胞内的溶酶体降解,组织LDL-R的循环利用,导致细胞表面LDL-R数量下降,而LDL-R又是肝细胞摄取并代谢血液中LDL的关键因子,因此PCSK9能提升低密度脂蛋白胆固醇(LDL-C)的水平。
目前,全球尚无口服PCSK9抑制剂获批上市。MK-0616的研发突破了此前只能通过注射给药的局限,提供了一个更为方便和可负担的治疗选择,有望成为全球首 款口服PCSK9抑制剂,改变高胆固醇血症患者的治疗方式,使更多患者临床获益。
2. KT-474:
口服 IRAK4 降解剂
研发企业:Kymera Therapeutics
适应症:特应性皮炎和化脓性汗腺炎
在研阶段:Ⅱ期
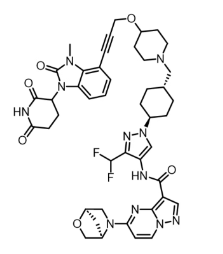
图:KT-474分子结构式
图片来源:Drug hunter
KT-474 是一种潜在的first-in-class的口服IRAK4降解剂,正在开发用于治疗TLR/IL-1R驱动的免疫炎症性疾病,例如特应性皮炎(AD)、化脓性汗腺炎(HS)、类风湿性关节炎等。与靶向单一细胞因子的单克隆抗体相比,KT-474旨在更广泛地阻断TLR/IL-1R介导的炎症,通过消除 IRAK4的激酶和支架功能来实现通路抑制。
2023年11月13日,Kymera Therapeutics公布了KT-474的Ⅰ 期临床试验取得积极结果,且发表于Nature Medicine。结果显示,该药物对缓解化脓性汗腺炎 (HS) 和特应性皮炎 (AD)患者的疾病负担和症状产生了积极的作用,且在中度至重度疾病患者中观察到了全身抗炎作用。
3. VX-548:
口服 NaV1.8 选择性抑制剂
研发企业:Vertex Pharmaceuticals
适应症:急性疼痛
在研阶段:Ⅲ期
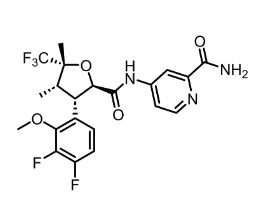
图:VX-548分子结构式
图片来源:Drug hunter
VX-548(Suzetrigine)是一种口服选择性NaV1.8抑制剂,与其它NaV离子通道相比,它对NaV1.8具有高度选择性。NaV1.8是在外周神经系统的痛觉信号传导中起到关键性作用的电压门控钠通道。它是经过遗传学验证的疼痛治疗靶点。Vertex的策略是通过选择性抑制NaV1.8,开发新的药物类型。与阿 片类药物相比,它们可能在提供更好镇痛效果的同时,避免上瘾等副作用。VX-548已获美国FDA授予快速通道资格与突破性疗法认定,用于治疗中度至重度急性疼痛。
VX-548有望在2024年内获批上市,成为全球首 款Nav1.8抑制剂药物,或将填补近二十年来无非阿 片类急性疼痛药物上市的空白,为医生和患者提供一种用药的新选择。
4. RMC-6291:
口服三复合物KRASG 12C(ON) 抑制剂
研发企业:Revolution Medicines
适应症:进展性实体瘤
在研阶段:I/Ib 期
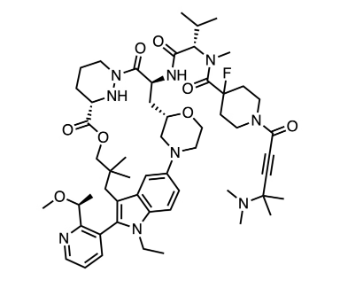
图:RMC-6291分子结构式
图片来源:Drug hunter
RMC-6291是一种口服、选择性、共价的KRAS G12C(ON) 抑制剂,旨在治疗由KRAS G12C突变体驱动的癌症患者,是Revolution Medicines第一个进入临床开发的突变体选择性RAS(ON)抑制剂和首次公开报道的KRAS G12C抑制剂,具有高度分化的作用机制。
RMC-6291的I/Ib 期试验是一项多中心、开放标签、剂量递增和剂量扩展研究,评估 RMC-6291 作为单一疗法治疗携带 KRASG12C 突变的晚期实体瘤患者的效果。RMC-6291展示了临床活性的初步证据和可接受的安全性特征,在不同剂量水平下通常具有良好的耐受性。
5. RLY-4008:
口服 FGFR2 抑制剂
研发企业:Relay Therapeutics
适应症:胆管癌
在研阶段:Ⅱ期
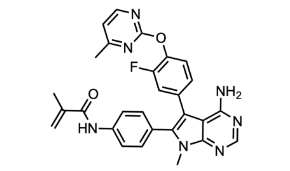
图:RLY-4008分子结构式
图片来源:Drug hunter
RLY-4008(Lirafugratinib)是一种口服药物,是高度选择性的FGFR2抑制剂,旨在针对驱动基因变异和FGFR2抵抗突变。它能分别对FGFR1和FGFR4表现出大于250倍和大于5000倍的选择性,并靶向原发性和耐药突变。在体内,RLY-4008在多个异体移植模型中诱导肿瘤消退,包括携带FGFR2耐药突变的模型,这些突变在当前泛-FGFRi上驱动临床进展,同时不抑制FGFR1和FGFR4。
RLY-4008定位一项Ⅰ /Ⅱ期研究中,招募了患有FGFR2融合/重排的CCA患者,报告了88%的ORR,100%的DCR,治疗中位时间为6个月。从该试验的数据中,对于患有CCA和FGFR2突变的患者,ORR为29%,对于已经对先前的FGFR抑制剂出现耐药的患者,ORR为21%(在RP2D时)。在早期临床试验中,RLY-4008诱导了反应,而没有临床显著的非等位FGFR毒性,证实了选择性FGFR2靶向的广阔治疗潜力。
6. Orforglipron:
口服非肽 GLP-1R 激动剂
研发企业:礼来/Chugai
适应症:肥胖症、2型糖尿病
在研阶段:Ⅲ期
图:orforglipron分子结构式
图片来源:Drug hunter
Orforglipron最初由中外制药开发,是一种可口服的非肽类胰高血糖素样肽-1受体(GLP-1R)激动剂。2018年9月,礼来与中外制药达成许可协议,以5000万美元首付款获得该产品的全球开发权和商业化权。
此前,礼来公布了orforglipron治疗2型糖尿病患者中的一项II期研究数据(NCT05048719),与基线相比,在治疗第26和36周,Orforglipron(12mg、24mg、36mg和45mg)平均体重降低的获益更为明显(-2.0% vs. -8.6~12.6%;-2.3% vs. -9.4%~14.7%)。对于有效性估计目标,研究26周时,orforglipron组受试者A1c平均降幅高达2.1%,而安慰剂组为0.4%,度拉糖肽组为1.1%(平均基线8.1%)。
7. Resmetirom:
口服THR β选择性激动剂
研发企业:Madrigal Pharmaceuticals
适应症:NASH
在研阶段:Ⅲ期
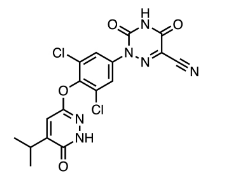
图:resmetirom分子结构式
图片来源:Drug hunter
Resmetirom(Rezdiffra)是由Madrigal研发的一款每日一次的口服甲状腺激素受体(Thr)-β选择性激动剂,于2023年3月15日获FDA批准上市,成为全球首 个治疗代谢功能障碍相关脂肪性肝炎(MASH,曾称为NASH)成人患者的药物,获批规格为60 mg、80 mg、100 mg。
在此之前,MASH治疗药物领域长期处于一片空白的状态,MASH患者群体基本上无药可用。Resmetirom的获批主要基于其优异的临床III期结果,III期试验MAESTRO-NASH结果显示Resmetirom达到了NASH缓解和纤维化改善两个组织学主要终点。
8.Ritlecitinib:
高选择性JAK3/TEC家族激酶双重抑制剂
研发企业:辉瑞
适应症:斑秃
在研阶段:已上市
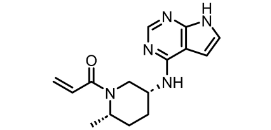
图:Ritlecitinib分子结构式
图片来源:Drug hunter
Ritlecitinib(利特昔替尼)是一种口服高选择性JAK3/TEC家族激酶双重抑制剂,于2023年6月获美国食品药品监督管理局(FDA)批准用于治疗12岁以上的严重斑秃的患者,成为全球首 个获批治疗青少年斑秃的药物。2023年11月,Ritlecitinib在中国获批上市,用于治疗12岁及以上青少年和成人重度斑秃。
Ritlecitinib的获批是基于一项ALLEGRO 2b/3期临床试验(NCT03732807)的结果。研究结果显示,在治疗24周后,相较于安慰剂组,ritlecitinib 50 mg组和30 mg组的患者中有更高比例的人实现了头皮脱发程度≤20%(绝 对SALT评分≤20),在统计学上具有显著差异。
9. Omaveloxolone:
口服 Nrf2 激动剂
研发企业:Reata Pharma/渤健
适应症:弗里德赖希共济失调症
在研阶段:已上市
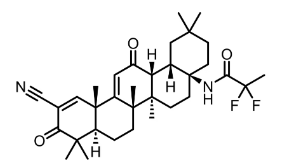
图:omaveloxolone分子结构式
图片来源:Drug hunter
Omaveloxolone(Skyclarys)是一款每日口服一次的Nrf2激动剂。Nrf2是一种转录因子,通过恢复线粒体功能、减少氧化应激和抑制促炎信号来促进炎症消退。
2023年2月28日,omaveloxolone获得FDA批准上市,用于治疗16岁及以上青少年和成年人弗里德赖希共济失调症(Friedreich’s Ataxia,FA)。这是美国首 个也是唯一获批治疗FA的药物。2023年7月底,渤健以每股172.5美元的价格现金收购Reata,交易总额约为73亿美元。
10.Nirogacestat:
口服分泌酶抑制剂
研发企业:辉瑞/ SpringWorks Therapeutics
适应症:硬纤维瘤、卵巢颗粒细胞瘤
在研阶段:Ⅲ期、 Ⅱ期
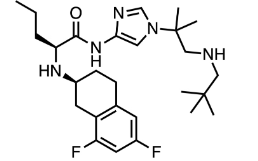
图:nirogacestat分子结构式
图片来源:Drug hunter
Nirogacestat是一种口服、选择性、小分子γ分泌酶抑制剂,目前处于硬纤维瘤的Ⅲ期临床开发和卵巢颗粒细胞瘤的Ⅱ期临床开发中。
Nirogacestat已获得FDA指定用于治疗硬纤维瘤和欧盟委员会指定用于治疗软组织肉瘤的孤儿药。FDA还授予其快速通道和突破性治疗资格,用于治疗患有进行性、不可切除、复发性或难治性硬纤维瘤或深部纤维瘤的患者。
SpringWorks正在评估Nirogacestat作为BCMA增效剂,并与行业领先的 BCMA开发人员进行了多次合作,以评估跨模式组合的Nirogacestat。SpringWorks还与Fred Hutchinson癌症研究中心和Dana-Farber癌症研究所建立了研究合作关系,以使用各种临床前多发性骨髓瘤模型进一步表征 Nirogacestat 调节BCMA和增强BCMA定向疗法的能力。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57