2024年4月7日,国家药品监督管理局(NMPA)官网送达信息显示,罗氏(Roche)提交的利妥昔单抗注射液(皮下注射)上市申请已正式获批。

罗氏此次获批的利妥昔单抗注射液(皮下注射)是一种含有透明质酸酶的皮下制剂,可暂时且可逆地降解透明质酸。透明质酸是一种在皮下细胞之间形成屏障的凝胶状物质。该皮下制剂能够在更大面积上快速分散和吸收。
利妥昔单抗由罗氏旗下基因泰克(Genentech)公司研发,最早在1997年11月26日于美国获批,是一个针对表面具CD20标记的靶细胞的治疗性单克隆抗体。
在美国、欧洲和其他国家,利妥昔单抗被批准用于治疗患有以下血癌的成人:既往未经治疗的复发/难治性滤泡性淋巴瘤、既往未经治疗的弥漫性大B细胞淋巴瘤以及既往未经治疗的复发/难治性慢性淋巴细胞白血病;还被批准用于治疗成人自身免疫性疾病:严重活动性类风湿关节炎、寻常型天疱疮以及严重活动性肉芽肿性多血管炎和显微镜下多血管炎。
利妥昔单抗注射液(商品名:美罗华)于2000年在中国上市,已获批了非霍奇金淋巴瘤、慢性淋巴细胞白血病、滤泡性淋巴瘤等适应症。目前国内上市的利妥昔单抗生物类似药有4款,具体信息如下:
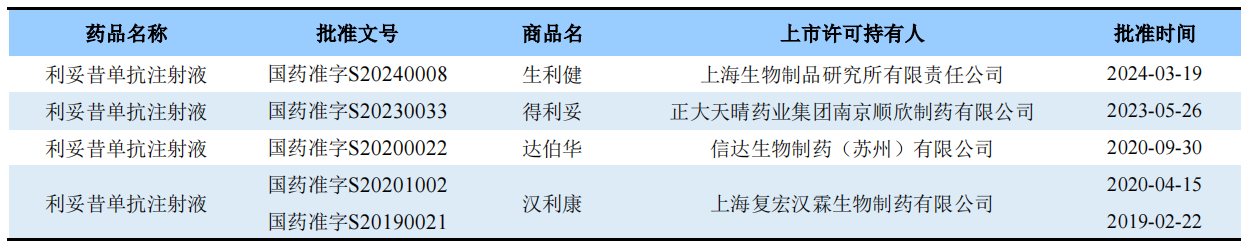
图片来源:药渡数据
除此之外,国内利妥昔单抗类似物申报上市的企业有盛禾(中国)生物制药、山东新时代药业以及上海中信国健药业;处于III期临床阶段的企业有华兰基因工程、南京优科生物以及浙江海正药业等。
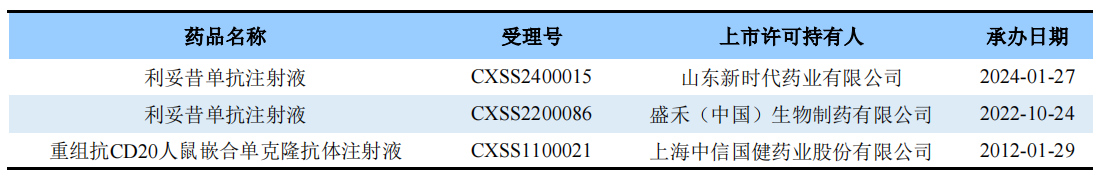
图片来源:药渡数据



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57